
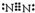 .
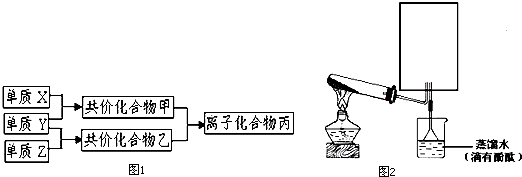
.分析 短周期元素的单质X、Y、Z在通常状况下均为气态,且均为双原子单质,X是空气中含量最多的气体,则X为N2,Y与Z反应生成乙,乙溶于水即得盐酸,则乙为HCl,Y、Z分别为Cl2、H2中的一种,X与Y反应生成甲,甲可使湿润的酚酞试纸变红,则Y为H2、Z为Cl2、甲为NH3,甲与乙反应生成丙为NH4Cl,据此解答.
解答 解:短周期元素的单质X、Y、Z在通常状况下均为气态,且均为双原子单质,X是空气中含量最多的气体,则X为N2,Y与Z反应生成乙,乙溶于水即得盐酸,则乙为HCl,Y、Z分别为Cl2、H2中的一种,X与Y反应生成甲,甲可使湿润的酚酞试纸变红,则Y为H2、Z为Cl2、甲为NH3,甲与乙反应生成丙为NH4Cl.
(1)X为N2,电子式是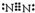 ,故答案为:
,故答案为: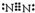 ;
;
(2)甲和乙反应的化学方程式:NH3+HCl=NH4Cl,故答案为:NH3+HCl=NH4Cl;
(3)①氨气是比空气轻的易溶于水的气体,应用向下排空气方法收集,收集氨气的装置图为 ,
,
故答案为: ;
;
②实验室利用Ca(OH)2和NH4Cl 在加热条件下反应得到氨气,
故答案为:Ca(OH)2和NH4Cl;
③氨气极易溶于水,烧杯中形成一水合氨溶液,一水合氨存在电离生成铵根离子和氢氧根离子,即NH3•H2O?NH4++OH-,显碱性,遇到酚酞由无色变为红色,
故答案为:NH3•H2O?NH4++OH-.
点评 本题考查无机物的推断,难度不大,注意把握题中信息、认真审题,学习中注重相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28gN2含有的原子数为2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-数为3NA | |
| C. | 标准情况下,2.24LCCl4含有的分子数NA | |
| D. | 常温常压下,22.4LCl2与足量铁充分反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s | B. | 2 min | C. | 3s | D. | 3 min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com