
”¾ĢāÄæ”æ
ÓŠ»ś»ÆŗĻĪļGŹĒŅ»ÖÖÉśĪļ½µ½āĖÜĮĻ£¬ĘäŗĻ³ÉĀ·ĻßČēĻĀ:

¼ŗÖŖ£ŗ¢Ł![]() (R1”¢R2±ķŹ¾Ģž»ł)
(R1”¢R2±ķŹ¾Ģž»ł)
¢ŚE²»ÄÜÓėŅų°±ČÜŅŗ·¢Éś·“Ó¦£¬µ«ÄÜÓėNa·“Ó¦”£
¢Ū
(1)AµÄ»ÆѧĆū³ĘĪŖ________
(2)Éś³ÉBµÄ·“Ó¦ĄąŠĶĪŖ________£¬Éś³ÉCµÄ·“Ó¦ĄąŠĶĪŖ________
(3)ÓÉBÉś³ÉCµÄ»Æѧ·½³ĢŹ½ĪŖ________
(4)GµÄ½į¹¹¼ņŹ½ĪŖ________
(5)EµÄĶ¬·ÖŅģ¹¹Ģåŗܶą£¬ÄÜĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄĮ“ד»ÆŗĻĪļ¹²ÓŠ________ÖÖ(²»ŗ¬Į¢ĢåŅģ¹¹)£¬ĘäÖŠŗĖ“Ź²ÕńĒāĘ×ÓŠ4×é·åÖµ£¬ĒŅ·åĆ껿±ČĪŖ2:2:1:1µÄ½į¹¹¼ņŹ½ĪŖ_______”£
¢Łŗ¬ÓŠČżÖÖ¹ŁÄÜĶÅ;¢ŚÄÜÓėŠĀÖʵÄCu(OH)2Šü¶ĄŅŗ·“Ó¦;¢ŪŃõŌ×Ó²»ÓėĢ¼Ģ¼Ė«¼üĻąĮ¬¢ÜÓėNa·“Ó¦æɷųöĒāĘų”£
(6)Š“³öÓƱ½ŗĶCH3COClĪŖŌĮĻÖʱø»ÆŗĻĪļ![]() µÄŗĻ³ÉĀ·Ļß(ĪŽ»śŹŌ¼ĮČĪŃ”)£ŗ_____”£
µÄŗĻ³ÉĀ·Ļß(ĪŽ»śŹŌ¼ĮČĪŃ”)£ŗ_____”£
”¾“š°ø”æ »·¼ŗĶé Č”“ś·“Ó¦ ĻūČ„·“Ó¦ ![]()
![]() 3
3 ![]()

”¾½āĪö”æ(1)±½ÓėĒāĘųŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¼Ó³É·“Ӧɜ³ÉA£Ø![]() £©£¬ĘäĆū³ĘĪŖ»·¼ŗĶ飻(2)
£©£¬ĘäĆū³ĘĪŖ»·¼ŗĶ飻(2)![]() ŌŚ¹āÕÕĻĀÓėBr2·¢ÉśČ”“ś·“Ӧɜ³ÉB£Ø
ŌŚ¹āÕÕĻĀÓėBr2·¢ÉśČ”“ś·“Ӧɜ³ÉB£Ø![]() £©£¬
£©£¬![]() ·¢ÉśĻūČ„·“Ӧɜ³ÉC£Ø
·¢ÉśĻūČ„·“Ӧɜ³ÉC£Ø![]() £©£»(3)
£©£»(3) ![]() ŌŚĒāŃõ»ÆÄĘ“¼ČÜŅŗÖŠ·¢ÉśĻūČ„·“Ӧɜ³É
ŌŚĒāŃõ»ÆÄĘ“¼ČÜŅŗÖŠ·¢ÉśĻūČ„·“Ӧɜ³É![]() £»»Æѧ·½³ĢŹ½ĪŖ£ŗ
£»»Æѧ·½³ĢŹ½ĪŖ£ŗ![]() £»(4)øł¾ŻŠÅĻ¢¢Ś£¬²¢½įŗĻFµÄ·Ö×ÓŹ½æÉÖŖ£¬1øöCH
£»(4)øł¾ŻŠÅĻ¢¢Ś£¬²¢½įŗĻFµÄ·Ö×ÓŹ½æÉÖŖ£¬1øöCH![]() CH·Ö×ÓÓė2øöHCHO·Ö×Ó·¢Éś¼Ó³É·“Ӧɜ³ÉE£ØHOCH2C
CH·Ö×ÓÓė2øöHCHO·Ö×Ó·¢Éś¼Ó³É·“Ӧɜ³ÉE£ØHOCH2C![]() CCH2OH£©”£HOCH2C
CCH2OH£©”£HOCH2C![]() CCH2OHŌŚŅ»¶ØĢõ¼žĻĀÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉHOCH2CH2CH2CH2OH”£øł¾ŻĢāÄæŠÅĻ¢·“Ó¦¢Ł£¬
CCH2OHŌŚŅ»¶ØĢõ¼žĻĀÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉHOCH2CH2CH2CH2OH”£øł¾ŻĢāÄæŠÅĻ¢·“Ó¦¢Ł£¬![]() ±»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»ÆÉś³ÉHOOC-(CH2)4-COOH(D), HOOC-(CH2)4-COOHÓėHOCH2CH2CH2CH2OHŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśĖõ¾Ū·“Ӧɜ³ÉG£¬Ęä½į¹¹¼ņŹ½ĪŖ
±»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»ÆÉś³ÉHOOC-(CH2)4-COOH(D), HOOC-(CH2)4-COOHÓėHOCH2CH2CH2CH2OHŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśĖõ¾Ū·“Ӧɜ³ÉG£¬Ęä½į¹¹¼ņŹ½ĪŖ![]() £»(5) HOCH2C
£»(5) HOCH2C![]() CCH2OHµÄĶ¬·ÖŅģ¹¹ĢåĪŖĮ“ד½į¹¹£¬¢Łŗ¬ÓŠČżÖÖ¹ŁÄÜĶÅ£»¢ŚÄÜÓėŠĀÖʵÄCu(OH)2Šü×ĒŅŗ·“Ó¦;¢ŪŃõŌ×Ó²»ÓėĢ¼Ģ¼Ė«¼üĻąĮ¬¢ÜÓėNa·“Ó¦æɷųöĒāĘų£¬Ōņ·Ö×ÓÖŠŗ¬ÓŠ-CHO”¢-OH£¬ŃõŌ×Ó²»ÄÜÓėĢ¼Ģ¼Ė«¼üÖ±½ÓĮ¬½Ó£¬·ūŗĻĢõ¼žµÄÓŠČēĻĀ3ÖÖĶ¬·ÖŅģ¹¹Ģå£ŗ
CCH2OHµÄĶ¬·ÖŅģ¹¹ĢåĪŖĮ“ד½į¹¹£¬¢Łŗ¬ÓŠČżÖÖ¹ŁÄÜĶÅ£»¢ŚÄÜÓėŠĀÖʵÄCu(OH)2Šü×ĒŅŗ·“Ó¦;¢ŪŃõŌ×Ó²»ÓėĢ¼Ģ¼Ė«¼üĻąĮ¬¢ÜÓėNa·“Ó¦æɷųöĒāĘų£¬Ōņ·Ö×ÓÖŠŗ¬ÓŠ-CHO”¢-OH£¬ŃõŌ×Ó²»ÄÜÓėĢ¼Ģ¼Ė«¼üÖ±½ÓĮ¬½Ó£¬·ūŗĻĢõ¼žµÄÓŠČēĻĀ3ÖÖĶ¬·ÖŅģ¹¹Ģå£ŗ![]() ”¢
Ӣ![]() Ӣ
”¢![]() £»ĘäÖŠ
£»ĘäÖŠ![]() ŗĖ“Ź²ÕńĒāĘ×ÓŠ4×é·å£¬ĒŅ·åĆ껿±ČĪŖ2:2:1:1£» (6)øł¾ŻĢāÄæŠÅĻ¢£¬±½ŗĶCH3COCl·¢ÉśČ”“ś·“Ӧɜ³É
ŗĖ“Ź²ÕńĒāĘ×ÓŠ4×é·å£¬ĒŅ·åĆ껿±ČĪŖ2:2:1:1£» (6)øł¾ŻĢāÄæŠÅĻ¢£¬±½ŗĶCH3COCl·¢ÉśČ”“ś·“Ӧɜ³É £¬
£¬ ÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³É
ÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³É £¬
£¬ ·¢ÉśĻūČ„·“Ӧɜ³É
·¢ÉśĻūČ„·“Ӧɜ³É![]() £¬
£¬![]() Óėäå·¢Éś¼Ó³É·“Ó¦µÄ²śĪļŌŁĖ®½āµĆµ½
Óėäå·¢Éś¼Ó³É·“Ó¦µÄ²śĪļŌŁĖ®½āµĆµ½![]() £¬ŌņŗĻ³ÉĀ·ĻßĪŖ£ŗ
£¬ŌņŗĻ³ÉĀ·ĻßĪŖ£ŗ ”£
ӣ


 ĆūŹ¦µć²¦¾ķĻµĮŠ“š°ø
ĆūŹ¦µć²¦¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾ČżøöÉÕĘæÖŠ·Ö±š×°ČĖŗ¬·ÓĢŖµÄ0.01mol/LCH3COONaČÜŅŗ£¬²¢·Ö±š·ÅÖĆŌŚŹ¢ÓŠĖ®µÄÉÕ±ÖŠ£¬Č»ŗóĻņÉÕ±¢ŁÖŠ¼ÓČėÉśŹÆ»Ņ£¬ĻņÉÕ±¢ŪÖŠ¼ÓČėNH4NO3¾§Ģ壬ÉÕ±¢ŚÖŠ²»¼ÓČĪŗĪĪļÖŹ£®ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£© 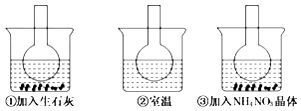
A.¢ŁĖµĆ÷Ė®½ā·“Ó¦ĪŖ·ÅČČ·“Ó¦
B.¢ŪĖµĆ÷Ė®½ā·“Ó¦ĪŖĪüČČ·“Ó¦
C.¢ŁÖŠČÜŅŗŗģÉ«±äĒ³
D.¢ŪÖŠČÜŅŗŗģÉ«±äÉī
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠīµē³Ų·Åµē”¢³äµēµÄ·“Ó¦Ź½ĪŖ£ŗFe+Ni2O3+3H2O ![]() Fe£ØOH£©2+2Ni£ØOH£©2 £¬ ĻĀĮŠĶʶĻÖŠÕżČ·µÄŹĒ£Ø””””£© ¢Ł·ÅµēŹ±£¬FeĪŖÕż¼«£¬Ni2O3ĪŖøŗ¼«£»
Fe£ØOH£©2+2Ni£ØOH£©2 £¬ ĻĀĮŠĶʶĻÖŠÕżČ·µÄŹĒ£Ø””””£© ¢Ł·ÅµēŹ±£¬FeĪŖÕż¼«£¬Ni2O3ĪŖøŗ¼«£»
¢Ś³äµēŹ±£¬Ņõ¼«ÉĻµÄµē¼«·“Ó¦Ź½ŹĒ£ŗFe£ØOH£©2+2e©ØTFe+2OH©£»
¢Ū³äµēŹ±£¬Ni£ØOH£©2ĪŖŃō¼«£»¢ÜŠīµē³ŲµÄµē¼«±ŲŠė½žŌŚÄ³¼īŠŌČÜŅŗÖŠ£®
A.¢Ł¢Ś¢Ū
B.¢Ł¢Ś¢Ü
C.¢Ł¢Ū¢Ü
D.¢Ś¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤Ņµ·ĻĘųÖŠµÄNO2”¢CO2¶Ō»·¾³¾ßÓŠ¼«“óÓ°Ļģ£¬ĄūÓĆ»Æѧ·“Ó¦ŌĄķ¶ŌĘ䓦Ąķ£¬¶Ō¹¹½Ø”°ĀĢĖ®ĒąÉ½”±ÉśĢ¬ĪÄĆ÷ÓŠÖŲŅŖŅāŅ唣Ēė»Ų“šĻĀĮŠĪŹĢā:
(1)ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_________
A.CO2ŗĶNO2ÓėĖ®·“Ó¦ĖłµĆČÜŅŗ¾łĪŖČõĖį
B.NO2ŌŚŅ»¶ØĢõ¼žĻĀÄÜÓėNH3·“Ӧɜ³É»·¾³ÓŃŗƵÄĪļÖŹ
C.Ķعż²ā¶ØČÜŅŗµÄpH£¬Ņ»¶ØÄÜÅŠ¶ĻH2CO3ŗĶHNO2µÄĖįŠŌĒæČõ
D.Na2CO3ČÜŅŗÖŠ¼ÓČėĮņĖįæÉÉś³ÉCO2
(2)H2ŌŚ“߻ƼĮ“ęŌŚĻĀÄÜÓėNO2·“Ӧɜ³ÉĖ®ÕōĘųŗĶµŖĘų¶ųĻūČ„¹¤ŅµĪ²ĘųÖŠNO2µÄĪŪČ¾£¬
ŅŃÖŖ:¢ŁN(g)+2O2(g)=2NO2(g)¦¤H=+133kJ/mol£»¢ŚH2O(g)=H2O(1)¦¤H=-44kJ/mol;¢ŪH2µÄČ¼ÉÕČČĪŖ285.8kJ/mol,øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ___________.
(3)CO2æÉŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖCH3OH”£¼ŗÖŖĻņ2LĆܱÕČŻĘ÷ÖŠ¼ÓČė2molCO2ŗĶ6molH2,ŌŚŹŹµ±µÄ“߻ƼĮŗĶT1ĪĀ¶ČĻĀ,·¢Éś·“Ó¦:CO2(g)+3H2(g) ![]() CH3OH(1)+H2O(1)¦¤H<O,10minŹ±“ļµ½Ę½ŗāדĢ¬£¬10minŗóøıäĪĀ¶ČĪŖT2,Éś³ÉĪļČ«²æĪŖĘųĢ壬20minŹ±“ļµ½Ę½ŗāדĢ¬£¬·“Ó¦¹ż³ĢÖŠ²æ·ÖŹż¾Ż¼ū±ķ:
CH3OH(1)+H2O(1)¦¤H<O,10minŹ±“ļµ½Ę½ŗāדĢ¬£¬10minŗóøıäĪĀ¶ČĪŖT2,Éś³ÉĪļČ«²æĪŖĘųĢ壬20minŹ±“ļµ½Ę½ŗāדĢ¬£¬·“Ó¦¹ż³ĢÖŠ²æ·ÖŹż¾Ż¼ū±ķ:
·“Ó¦Ź±¼ä | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
0min | 2 | 6 | 0 | 0 |
10min | 4.5 | |||
20min | 1 |
¢ŁĒ°10minÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹv(CO2)=_______£¬20minŹ±H2µÄ×Ŗ»ÆĀŹĪŖ_______”£
¢ŚŌŚĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀ£¬Čō30minŹ±Ö»øıäĪĀ¶ČĪŖT3,“ļĘ½ŗāŹ±H2µÄĪļÖŹµÄĮæĪŖ3.2mol,ŌņT2______T3(Ģī”°>”±”°<”±»ņ”°=”±)£¬ŌŚĪĀ¶ČT2Ź±£¬·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżĪŖ______”£
¢ŪŌŚT1ĪĀ¶ČĻĀ,½«ČŻĘ÷ČŻ»żĖõŠ”Ņ»±¶£¬·“Ó¦“ļĘ½ŗāŹ±CH3OHĪļÖŹµÄĮæĪŖ____mol.ŗĶøıäĻĀĮŠĢõ¼ž£¬ÄÜŹ¹H2µÄ·“Ó¦ĖŁĀŹŗĶ×Ŗ»ÆĀŹ¶¼Ņ»¶ØŌö“óµÄŹĒ____(Ģī±źŗÅ)”£
A.ŌŚČŻ»ż²»±äĻĀÉżøßĪĀ¶Č
B.ĘäĖüĢõ¼žĻĀ²»±ä£¬Ōö¼ÓŃ¹Ēæ
C.ŌŚČŻ»żŗĶĪĀ¶Č²»±äĻĀ³äČėN2
D.ŌŚČŻ»żŗĶĪĀ¶Č²»±äĻĀ¼°Ź±·ÖĄė³öCH3OH
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŗ¬ÓŠ½Ļ¶ąNH4+”¢Ba2+”¢NO3”„”¢Cl”„µÄČÜŅŗÖŠ»¹ÄÜ“óĮæ¹²“ęµÄĄė×ÓŹĒ£Ø””””£©
A.Ag+
B.H+
C.SO42”„
D.OH”„
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷ÕżČ·ĒŅÄÜ“ļµ½ĻąÓ¦ŹµŃéÄæµÄµÄŹĒ
Ń”Ļī | ŹµŃéÄæµÄ | ŹµŃé²Ł×÷ |
A | ÅäÖĘFeCl3ČÜŅŗ | ½«FeCl3¹ĢĢåČܽāÓŚŹŹĮæÕōĮóĖ® |
B | ³ĘČ”2.0gNaOH ¹ĢĢå | ĻČŌŚĶŠÅĢÉĻø÷·ÅŅ»ÕÅĀĖÖ½£¬Č»ŗóŌŚÓŅÅĢÉĻĢķ¼Ó2g ķĄĀė£¬×óÅĢÉĻĢķ¼ÓNaOH ¹ĢĢå |
C | ¼ģŃéČÜŅŗÖŠŹĒ·ńŗ¬ÓŠNH4+ | Ȕɣ×īŹŌŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČėNaOHČÜŅŗ²¢¼ÓČČ£¬ÓĆŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½¼ģŃé²śÉśµÄĘųĢå |
D | ŃéÖ¤ĢśµÄĪüŃõøÆŹ“ | ½«Ģś¶¤·ÅČėŹŌ¹ÜÖŠ£¬ÓĆŃĪĖį½žĆ» |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĪļÖŹ£ŗ A£®O2 ŗĶ O3
B£® ![]() O ŗĶ
O ŗĶ ![]() O
O
C£®CH3©CH2©CH2©CH3ŗĶCH3©CH£ØCH3£©CH3
D£®ČżĀČ¼×ĶéŗĶĀČ·Ā
E£®¼×ĶéŗĶøżĶé
F£®Ņģ¶”ĶéŗĶ 2©¼×»ł±ūĶé
£Ø1£©×黄ĪŖĶ¬Ī»ĖŲ£»
£Ø2£©×éĮ½ĪļÖŹ»„ĪŖĶ¬ĖŲŅģŠĪĢ壻
£Ø3£©×éĮ½ĪļÖŹŹōÓŚĶ¬ĻµĪļ£»
£Ø4£©×éĮ½ĪļÖŹ»„ĪŖĶ¬·ÖŅģ¹¹Ģ壻
£Ø5£©×éŹĒĶ¬Ņ»ĪļÖŹ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø»ņ±ķŹ¾·½·ØÕżČ·µÄŹĒ£Ø””””£©
A.µČĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢåŌŚŃõĘųÖŠ·Ö±šĶźČ«Č¼ÉÕ£¬·Å³öČČĮæŅ»Ńł¶ą
B.ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦
C.ŌŚ101kpaŹ±£¬2gH2ĶźČ«Č¼ÉÕ£¬Éś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8kJČČĮ棬ŌņĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ£ŗ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=©285.8kJ/mol
D.ŌŚĒæĖįĒæ¼īĻ”ČÜŅŗÖŠ£ŗH+£Øaq£©+OH©£Øaq£©=H2O£Øl£©”÷H=©57.3kJ/mol£¬Čō½«ŗ¬1molNaOHµÄČÜŅŗŗĶŗ¬0.5molH2SO4µÄÅØĮņĖį»ģŗĻ£¬·Å³öµÄČČĮæ“óÓŚ57.3 kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČŹ±£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ,X”¢Y”¢Z(¾łĪŖĘųĢå)ČżÖÖĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£

(1)ÓÉĶ¼ÖŠĖłøųŹż¾Ż½ųŠŠ·ÖĪö£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__________”£
(2)·“Ó¦“ÓæŖŹ¼ÖĮ2·ÖÖÓ,ÓĆZµÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖV(Z)= __________”£
(3)2min·“Ó¦“ļĘ½ŗā£¬ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ±ČĘšŹ¼Ź±______(ĢīŌö“󔢼õŠ”»ņ²»±ä)£»»ģŗĻĘųĢåĆܶȱČĘšŹ¼Ź±_______(ĢīŌö“󔢼õŠ”»ņ²»±ä).
(4)½«amolxÓėbmolYµÄ»ģŗĻĘųĢå·¢ÉśÉĻŹö·“Ó¦£¬·“Ó¦µ½Ä³Ź±æĢø÷ĪļÖŹµÄĮæĒ”ŗĆĀś×ć:n(X)=n(Y)=n(Z),ŌņŌ»ģŗĻĘųĢåÖŠa:b=__________”£
(5)ĻĀĮŠ“ėŹ©ÄܼÓæģ·“Ó¦ĖŁĀŹµÄŹĒ_________”£
A.ŗćŃ¹Ź±³äČėHe£»B.ŗćČŻŹ±³äČėHe£»C.ŗćČŻŹ±³äČėX£»D.¼°Ź±·ÖĄė³öZ£»E.ÉżøßĪĀ¶Č£» F.Ń”Ōńøߊ§µÄ“߻ƼĮ
(6)ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ__________”£
A.ÉżøßĪĀ¶Čøıä»Æѧ·“Ó¦µÄĻŽ¶Č
B.ŅŃÖŖÕż·“Ó¦ŹĒĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÓŅŅĘ¶Æ£¬Õż·“Ó¦ĖŁĀŹ¼Óæģ£¬Äę·“Ó¦ĖŁĀŹ¼õĀż
C.»Æѧ·“Ó¦µÄĻŽ¶ČÓėŹ±¼ä³¤¶ĢĪŽ¹Ų
D.»Æѧ·“Ó¦µÄĻŽ¶ČŹĒ²»æÉÄÜøıäµÄ
E.Ōö“óYµÄÅØ¶Č£¬Õż·“Ó¦ĖŁĀŹ¼Óæģ,Äę·“Ó¦ĖŁĀŹ¼Óæģ£¬Õż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ
F.¼ÓČėøߊ§“߻ƼĮæɼÓæģÕż”¢Äę·“Ó¦ĖŁĀŹ£¬»ÆŃ§Ę½ŗāÕżĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com