
下表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是

A.常温常压下,五种元素的单质中有两种是气态
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者
科目:高中化学 来源:2014-2015吉林省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作中,不正确的是
A.在蒸发食盐水时,边加热边用玻璃棒搅拌
B.焰色反应实验前,铂丝应先用盐酸洗涤
C.实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下
D.配制一定物质的量浓度的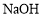 溶液,将
溶液,将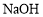 固体放在容量瓶中加水溶解
固体放在容量瓶中加水溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:填空题
(16分)平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=-a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=-a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①20s内B气体的平均化学反应速率为___________。
②下列各项中能说明该反应已经达到平衡状态的有 。
A.容器中气体的平均相对分子质量不随时间而变化
B.消耗1molA的同时消耗1molB
C.容器中气体的密度不随时间而变化
D.C的体积分数不随时间而变化
③保持容器温度和容积不变,若开始时向容器中加入2molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = 2a (B) Q1 + 2Q2 < 2a (C)Q1 + 2Q2 > 2a(D)Q1 + Q2 < a
④在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体,,重新达平衡后,B气体的转化率为60%,则b= 。
(2)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
25℃时H3PO3 H++H2PO的电离常数Ka=8.0×10-3 mol·L-1,该温度下NaH2PO3
H++H2PO的电离常数Ka=8.0×10-3 mol·L-1,该温度下NaH2PO3
水解反应的平衡常数Kh= mol·L-1。亚磷酸钠具有强还原性,可使碘水褪色。若向NaH2PO3溶液中加入少量I2,则溶液中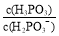 将 (填“变大”“变小”“不变”)。
将 (填“变大”“变小”“不变”)。
(3)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。
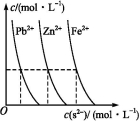
如果向三种沉淀中滴加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法正确的是
A.对“地沟油”进行分馏可以获得汽油发动机的燃料
B.用纯碱制玻璃、用铁矿石炼铁都会产生温室气体
C.海水中有大量人类需要的物质,可以大量开发海水中的物质,以解决资源短缺的问题
D.工业上以氯气和澄清石灰水为原料制造漂白粉
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
某学习小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e- = Cu
C. a和b分别连接直流电源正、负极,Cu2+向铜电极移动
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作中正确的是

A.图甲所示,可得到干燥的氢气
B.图乙所示,可以验证氯气的漂白性
C.图丙所示,可以验证SO2的漂白性
D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
①c1合理的数值为 。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)= 。
③不能作为判断该反应达到平衡状态的标志是 。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:

实验 编号 | T/oC | NO初始浓 度/10-3mol·L-1 | CO初始浓 度/10-3mol·L-1 | 催化剂的比 表面积/m2·g-1 |
① | 350 | 1.20 | 5.80 | 124 |
② | 280 | 1.20 | 5.80 | 124 |
③ | 280 | 1.20 | 5.80 | 82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为 。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K= 。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650oC下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液至恰好反应完全,下列说法正确的是
A.整个反应过程中:c(H+) + c(Na+) + c(NH4+)=c(OH-) + 2c(SO42-)
B.当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C.当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+)
D.当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
选考[化学——选修3:物质结构与性质] (13分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的价电子排布式 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O、P、S元素第一电离能由小到大的顺序为 。及电负性由小到大的顺序为 。
(2)氨基乙酸铜的分子结构如图,氮原子的杂化方式为 。
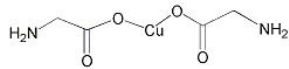
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为 。
(4)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com