
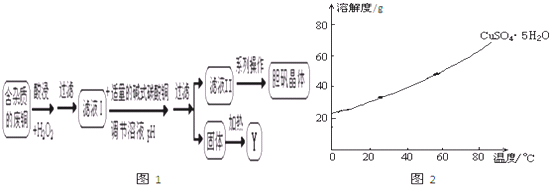
 ,故答案为:
,故答案为: ;
;| 10-39 |
| (10-10)3 |
| 10-39 |
| (10-10)3 |


科目:高中化学 来源: 题型:
| A、0.5 mol H2O含有的原子数目为1.5 NA |
| B、32 g O2所含的原子数目为NA |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5 NA个氯气分子的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
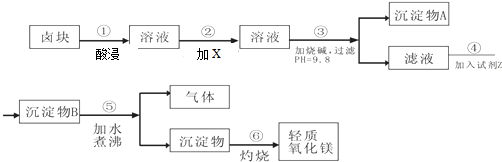
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
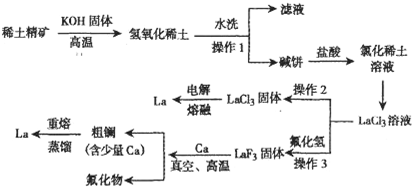
| 金属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1487 |
| 镧 | 920 | 3470 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
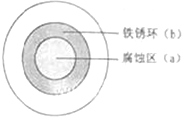
| A、液滴中的Cl-由a 区向b区迁移 |
| B、液滴边缘区发生的电极反应为:2H++2e-=H2 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、导致该现象的主要原因是液滴之下氧气含量比边缘处少. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验现象 | 结论 | |
| 实验① | ||
| 实验② |
查看答案和解析>>
科目:高中化学 来源: 题型:
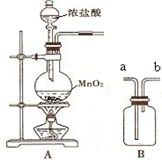 实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:
实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:| 实验目标 | 装填试剂 (填选项字母) | 气体流向 (填a、b) |
| 除去HCl杂质 | E | a→b |
| 干燥氯气 | C | a→b |
| 收集氯气 | D | |
| 检验氯气的氧化性 | F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com