
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)NO2与水反应生成硝酸和NO,6NO2+8NH3 $\frac{\underline{催化剂}}{△}$7N2+12H2O反应中,只有N元素化合价发生变化,分别由+4价、-3价变化为0价;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kj•mol-1 ②2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ•mol-1,利用盖斯定律将$\frac{①-②}{2}$可得反应热;
(3)①起始时压强相等,则反应物的浓度相等,反应速率相等;
②c为恒压,c中压强大于a,结合压强对反应速率的影响判断;
③如起始在a、c两容器中通入同量的N2,N2不参加反应,c保持恒压,则体积应增大,结合浓度的影响判断反应速率.
解答 解:(1)NO2与水反应生成硝酸和NO,反应的方程式为3NO2+H2O=2HNO3+NO,
6NO2+8NH3 $\frac{\underline{催化剂}}{△}$7N2+12H2O反应中,只有N元素化合价发生变化,分别由+4价、-3价变化为0价,由化合价变化可知当有6molNO2参加反应时,转移24mol电子,
则当转移1.2mol电子时,消耗的NO2的物质的量为0.3mol,在标准状况下是0.3mol×22.4L/mol=6.72L,
故答案为:3NO2+H2O=2HNO3+NO;6.72L;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kj•mol-1 ②2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ•mol-1
则$\frac{①-②}{2}$可得NO2(g)+SO2(g)?SO3(g)+NO(g)的△H3=$\frac{-196.6kJ/mol+113.9kJ/mol}{2}$=-41.8kJ/mol,
故答案为:-41.8;
(3)①起始时压强相等,则反应物的浓度相等,反应速率相等,故答案为:=;
②c为恒压,c中压强大于a,反应一段时间后a、c中速率大小关系为Va<Vc,故答案为:<;
③如起始在a、c两容器中通入同量的N2,N2不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa=Pb>Pc,反应速率Va=Vb,由于c体积最大,浓度最小,则反应速率最小,故答案为:=;>;=;>.
点评 本题考查较为综合,涉及氧化还原反应计算、物质的分类以及盖斯定律的应用等知识,为高频考点,侧重于学生的分析、计算能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L液态水中含有的H+数目为10-7 NA | |
| B. | 标准状况下,2.24 L D2O中含有的电子数为NA | |
| C. | 3.4g H2O2中含有的共用电子对数为0.1 NA | |
| D. | 1mol碳烯(:CH2)中含有的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的缩写代号为PMMA,俗称有机玻璃.下列说法中错误的是( )
)的缩写代号为PMMA,俗称有机玻璃.下列说法中错误的是( )| A. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| D. | 甲基丙烯酸甲酯中碳原子可能都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2、8、18、32、72、98 | B. | 2、8、8、18、18、32 | C. | 2、8、8、18、32、32 | D. | 2、8、18、32、32、72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
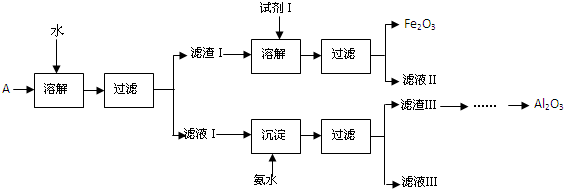
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com