
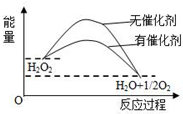
| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
分析 A、催化剂只通过改变活化能来改变反应速率,不改变反应的热效应;
B、催化剂只改变反应速率不改变化学平衡;
C、图象分析反应是放热反应,热化学方程式要注明状态;
D、图象分析反应是放热反应,反应物的总能量高于生成物的总能量.
解答 解:A、催化剂只通过改变活化能来改变反应速率,不改变反应的热效应;故A错误;
B、催化剂只改变反应速率不改变化学平衡,反应体系中加入催化剂不改变H2O2的平衡转化率,故B错误;
C、图象分析判断反应是放热反应,热化学方程式要注明状态,所以H2O2分解的热化学方程式:H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H<0,故C错误;
D、图象分析反应是放热反应,所以反应物的总能量高于生成物的总能量,故D正确;
故选D.
点评 本题考查了化学平衡、化学反应能量的图象分析判断,注意催化剂改变速率不改变平衡的理解,题目难度中等.


科目:高中化学 来源: 题型:解答题
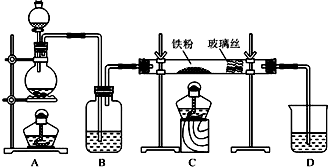
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R′代表烃基)
(R、R′代表烃基)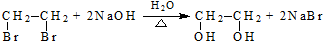 .
. .
. (C10H10O4)的同分异构体中,满足下列条件的有5种.
(C10H10O4)的同分异构体中,满足下列条件的有5种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
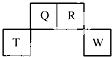 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,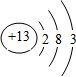 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使品红试液褪色 | |
| B. | 都能和氢氧化钠溶液反应生成盐和水 | |
| C. | 都有刺激性气味 | |
| D. | 常温下都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 氯化铁溶液滴加到沸水中得到Fe(OH)3 胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 铁溶于盐酸产生H2:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com