
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100ml稀盐酸 |
| NaOH溶液 |
| 100mlNaOH溶液 |
| 稀盐酸 |
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
| 2.7g |
| 27g/mol |
| 2.7g |
| 27g/mol |


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
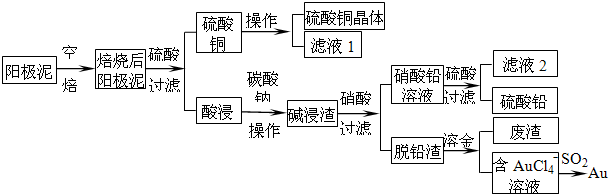
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
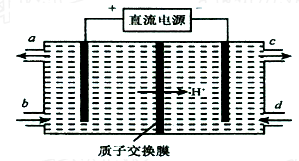
 图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )
图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )| a电极 | b电极 | X电极 | 溶液 | 所加物质 | |
| A | 锌 | 石墨 | 负极 | CuSO4 | CuO |
| B | 石墨 | 石墨 | 负极 | NaOH | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 | CuO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
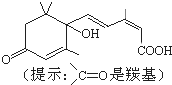 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )| A、此有机物含有如下的官能团:含有碳碳双键、羟基、羰基、羧基 |
| B、1mol该有机物与NaOH 溶液反应,耗2mol.与氢气反应耗氢气5mol |
| C、该有机分子中没有一个有手性碳 |
| D、该有机物不存在顺反异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4与原溶剂水互不溶解 |
| B、CCl4与水和碘都不发生化学反应 |
| C、CCl4是有机溶剂,且密度比水大 |
| D、碘在CCl4中的溶解度比在水中的大得多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com