
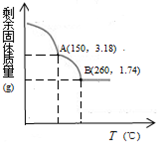
 某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:
某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:分析 (1)固体灼烧需要在坩埚中加热灼烧;
(2)依据溶度积常数计算Ksp=c(Cu2+)c2(OH-);
(3)证明沉淀已洗涤干净,需要取用最后一次的洗涤液加入硝酸酸化的硝酸银溶液检验氯离子是否存在设计实验检验;
(4)该晶体在150℃时失去结晶水,则n(H2O)═$\frac{3.54g-3.18g}{18g/mol}$=0.02mol,
260℃时分解,H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O△m
1mol (28+44)g
n (3.18-1.74)g
n(C2O42-)═0.02mol,
将灼烧剩余固体加入到过量的稀盐酸中完全溶解,再向其中滴加NaOH溶液至过量,过滤、洗涤、干燥、灼烧得固体质量为0.80g为CuO的质量,
n(Cu2+)═n(CuO)=$\frac{0.8g}{80g/mol}$=0.01mol,
据电荷守恒得n(K+),得到化学式;
解答 解:(1)灼烧时用到的主要仪器有酒精灯、玻璃棒和坩埚,
故答案为:坩埚;
(2)Ksp=c(Cu2+)c2(OH-),c(Cu2+)≤1×10-5mol•L-1时为沉淀完全,则c2(OH-)=$\frac{1.0×1{0}^{-20}}{1.0×1{0}^{-5}}$=1.0×10-15,
c(OH-)=1×10-7.5mol/L
则反应后溶液中的c(OH-)≥1×10-7mol/L,
故答案为:1×10-7mol/L;
(3)洗涤沉淀时,证明沉淀已洗涤干净的方法是:取最后一次洗涤液,向其中滴加硝酸酸化的AgNO3溶液,如无白色沉淀生成,则沉淀洗涤干净,
故答案为:取最后一次洗涤液,向其中滴加硝酸酸化的AgNO3溶液,如无白色沉淀生成,则沉淀洗涤干净;
(4)该晶体在150℃时失去结晶水,则n(H2O)═$\frac{3.54g-3.18g}{18g/mol}$=0.02mol,
260℃时分解,H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O△m
1mol (28+44)g
n (3.18-1.74)g
n(C2O42-)═0.02mol,
将灼烧剩余固体加入到过量的稀盐酸中完全溶解,再向其中滴加NaOH溶液至过量,过滤、洗涤、干燥、灼烧得固体质量为0.80g为CuO的质量,
n(Cu2+)═n(CuO)=$\frac{0.8g}{80g/mol}$=0.01mol,
据电荷守恒得:
n(K+)═2 n(C2O42-)-2 n(Cu2+)═0.02mol×2-0.02mol×2═0.02mol,
n(K+):n(Cu2+):n(C2O42-):n(H2O)═0.02mol:0.01mol:0.02mol:0.02mol═2:1:2:2,
则该铜盐的化学式为:K2[Cu(C2O4)2]•2H2O,
答:该铜盐的组成为K2[Cu(C2O4)2]•2H2O.
点评 本题考查了固体成分放热测定和计算分析,主要是图象变化和差量计算的应用,注意题干信息的理解,题目难度中等.


科目:高中化学 来源: 题型:选择题
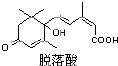 脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )
脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )| A. | 脱落酸的化学式C15H18O4 | |
| B. | 脱落酸只能和醇类发生酯化反应 | |
| C. | 1 mol 脱落酸最多可以和2 mol 金属钠发生反应 | |
| D. | 1 mol 脱落酸最多可以和2 mol 氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯为纯净物;聚乙烯为混合物 | |
| B. | 等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 乙烯的化学性质比聚乙烯活泼 | |
| D. | 乙烯和聚乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的物质的量浓度 | B. | 混合气体的压强 | ||
| C. | 混合气体总物质的量 | D. | v(C)与v(D)的比值 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com