
����Ŀ����2HI��g��![]() H2��g��+I2��g���У����ַ��ӻ�ѧ������ʱ�����仯��ͼ1��ʾ������������ͬ��1 mol HI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��I2���ʵ������¶ȱ仯��������ͼ2��ʾ��
H2��g��+I2��g���У����ַ��ӻ�ѧ������ʱ�����仯��ͼ1��ʾ������������ͬ��1 mol HI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��I2���ʵ������¶ȱ仯��������ͼ2��ʾ��
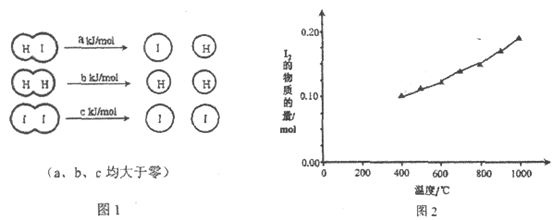
��1���Ƚ�2a________b+c���<������>����=������������________________��
��2��ij�¶��¸÷�Ӧƽ�ⳣ��Ϊ1��64����ƽ��ʱ��1 mol HI�ֽ��ת����Ϊ________________��
��3�������ô˷�Ӧ�Ʊ�I2�������HIת���ʵĴ�ʩ��________������ĸ��ţ���
a. ����I2 b. ��ѹ c. ���� d. ����HIŨ��
���𰸡� > ������������ʱ�������¶ȣ�n��I2�����ӣ�����ӦΪ���ȷ�Ӧ������ 2a>b+c 20�� ac
����������1����ͼ2�õ��������¶����ߣ�I2�����ʵ��������������������¶�ƽ�������ƶ�������Ӧ�������������ȷ�Ӧ��Ӧ���Ƿ�Ӧ����ܼ��ܣ���Ӧʱ�ϼ����յ�������������������ܼ��ܣ�����ʱ�ɼ��ų�����������2a��b+c��
��2��������Ŀ���ݽ������¼��㣺
2HI��g��![]() H2��g��+ I2��g��
H2��g��+ I2��g��
��ʼ�� 1 0 0
��Ӧ�� 2X X X
ƽ���� 1-2X X X
������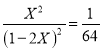 �� X=0.1�����Է�Ӧ��HIΪ0.2mol��ת����Ϊ20%��
�� X=0.1�����Է�Ӧ��HIΪ0.2mol��ת����Ϊ20%��
��3������I2ƽ�������ƶ���HIת�������ߣ�ѡ��a��ȷ���÷�Ӧ���������ʵ�������ķ�Ӧ������ѹǿ��Ӱ��ƽ��̬��ѡ��b���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���HI��ת�������ߣ�ѡ��c��ȷ�������£�������������ʵ�������ķ�Ӧ��ֻҪ��֤Ͷ�ϱ���Ⱦ��ǵ�Чƽ�⡣�÷�Ӧ�ķ�Ӧ��ֻ��һ�֣����ۼӶ��ٶ���Ͷ�ϱ���ȣ���������HI��Ũ�Ⱥ�ʵ�ʽ���һ����Чƽ��̬��HI�ķֽ�ת���ʲ��䣬ѡ��d����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15mL0.lmol��L-1KOH��Һ����μ���0.2mol��L-1������Һ����ҺpH�ͼ�����ᣨ���ᣩ�������ϵ������ͼ��ʾ�����й�ϵ��ȷ���ǣ� ��

A. ��B�㣺c(K+)=c(HCOO-)��c(OH-)=c(H+)����a=7.5
B. ��A��B������һ�㣬c(HCOO-)��c(K+)��c(OH-)��c(H+)
C. ��D�㣺c(HCOO-)+c(HCOOH)��2c(K+)
D. B��C�Σ�ˮ�ĵ���̶���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɫ��Һ�д��������һ�������ǣ� ��
A.Cu2+��SO42����OH����K+
B.Fe3+��NO3����Cl����H+
C.K+��CO32����Cl����H+
D.H+��Na+��Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش���������:
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_________________��
��2��C2F4�����ںϳɾ��ķ���ϩ,HBF4������ʴ�̲�����NO2F����������ƽ����е���������NaAlF6��������ұ�����������
��C2F4�������������ۼ���������_____��C2F4������̼ԭ�ӵ��ӻ����������____�����ķ���ϩ��һ�����壬֤�������Ǿ�����õ�ʵ�鷽����_______________��
��HF��BF3���Ͽɵõ�HBF4���Ӽۼ��γɽǶȷ���HF��BF3�ܻ��ϵ�ԭ��_______________��
����NO2F���ӻ�Ϊ�ȵ��ӵķǼ��Է�����__________(дһ������Ҫ��Ļ�ѧʽ����)��
��3��CaF2�ľ���ṹ��ͼ��ʾ��

��CaF2�����У�Ca2+����λ��Ϊ_____��F-����λ��Ϊ_____��
��ԭ����������ɱ�ʾ�����ڲ���ԭ�ӵ����λ�ã���֪A��B�����ԭ�����������ͼ��ʾ����C���ԭ���������Ϊ______________��
�۾������������������Ĵ�С����״��CaF2�����ľ���������A=546.2pm�������ܶ�Ϊ_____(�г�����ʽ����)g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ���Ҵ�Ϊԭ����ȡ����������Ĺ����з����ķ�Ӧ���ͼ�˳����ȷ����
��������Ӧ ��������Ӧ ��ˮ�ⷴӦ �ܼӳɷ�Ӧ
A. �ڢܢۢ� B. �ܢ٢ڢ� C. �ܢۢڢ� D. �ڢۢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ķе��Ǽ���:-164��,����-89��,����:-42��,����:36�档�ɴˣ��ƶ϶���ķе���ܣ�
A.����-170��B.ԼΪ-1��C.����36��D.-100��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �����£���3��һԪ��ֱ��NaOH��Һ�������ϣ�ʵ���������£�
��� | c��һԪ�ᣩ��c��H+�� | c��NaOH����mol/L | �����Һ��pH |
�� | c��H+��=0.1 mol��L��HX�� | 0.1 | pH=a |
�� | c��HY��=0.1mol��L | 0.1 | pH=7 |
�� | c��HZ��=0.1 mol��L | 0.1 | pH=9 |
��1������ʵ����HXΪ���ᣬa______7���<������=����>������
��2������ʵ����HY��Һ��pH=______��
��3������ʵ�鷢����Ӧ�����ӷ���ʽΪ__________________��
������Һ����ˮ�������c��OH-��=______mol/L��
II. ��0.1 mol��L-1 NaOH��Һ�ֱ���������Ϊ20 mL��Ũ�Ⱦ�Ϊ0.1 mol��L-1 HCl��Һ��HA��Һ����Һ��pH�����NaOH��Һ����仯��ͼ��

��1��HAΪ_______�ᣨ�ǿ������������
��2��N��pH>7��ԭ���ǣ������ӷ���ʽ��ʾ��_________��
��3������˵����ȷ����_______ ������ĸ����
a. M��c��HA��-��
b. M��c��Na+��>c��OH-��
c. P��c��Cl-��=0.05 mol��L-1
��4��NaA��NaOH��Ũ�ȵ�������ʱ����Һ��c��A-��______c��OH-�����<������=����>����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����Դ�ı��⣬��ˮ�����ɻ�õ�ˮ��Ũ��ˮ��Ũ��ˮ����Ҫ���е�������Na+�� Mg2+ ��Cl����SO42������Ũ��ˮ����ȡ����þ��һ�ι���������ͼ��ʾ��
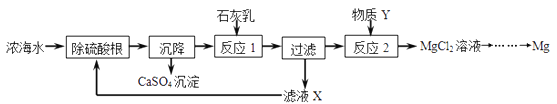
��1��д����Ӧ2�Ļ�ѧ����ʽ��_________________________________________��
��2�����������п�ѭ��ʹ�õ�������___________���ѧʽ����
��3����ʵ�������֤����Һ�е�SO42������ȫ������_____________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ��ص�������ȷ����(�� ��)
A.ԭ��طŵ�ʱ�������ɸ������������Һ��������
B.ԭ����ǽ�����ת��Ϊ��ѧ�ܵ�װ��
C.��ԭ����У����������һ���Ǹ������õ缫����������Ӧ
D.����ԭ��ص������������������ֲ�ͬ�Ľ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com