




 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源:2010年辽宁省师大附中高一下学期期中考试 题型:填空题
(7分)(1)写出一个能证明还原性Fe比Cu强的离子方程式:
;
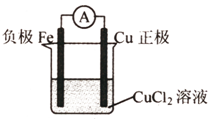
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液)
;
(3)若该电池中两电极的总质量为60 g,工作一段时间后,取出两电极洗净干燥后称量,总质量为46 g,则反应过程中转移电子的数目为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年江苏省宿迁中学高一(下)期末化学模拟试卷(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省菏泽市高一(下)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com