
��Ȼ�����ɿ����� ��a��b��cΪ��������ʾ������A��B���ֲ�ͬ����Ȼ����Ʒ���ֱ��������ʵ����ȷ���仯ѧʽ��
��a��b��cΪ��������ʾ������A��B���ֲ�ͬ����Ȼ����Ʒ���ֱ��������ʵ����ȷ���仯ѧʽ��
������Ϊ31.0 g����Ȼ��A��300����ȷֽ�����ȫ��300��ʱNa2CO3���ֽ⣩������CO2 2.24 L����״������ˮ5.4 g��
��1����Ȼ��A�Ļ�ѧʽ�У�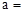 ����������������
���������������� ����������������
���������������� ����������������
����������������
��֪��Na2CO3��ϡ����ķ�Ӧ�������������У�
Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2��+H2O
NaCl+CO2��+H2O
������Ϊ12.45 g����Ȼ��B����ˮ����εμ�ijŨ�ȵ�ϡ���ᣬ�������������������
����������״�����Ĺ�ϵ���±���ʾ��
|
���������mL�� |
20 |
40 |
60 |
80 |
|
�������������mL�� |
0 |
560 |
1680 |
2520 |
��2���ɱ������ݿ��Ʋ����50mL����ʱ��������������Ϊ����������������mL����״�����������Ũ��Ϊ��������������mol/L����Ȼ��B�Ļ�ѧʽΪ�������������������� ������
��3����ȡһ����������Ȼ��B���뵽30mL��Ũ�ȵ������У���д�������������V��mL����״��������Ȼ��B����W(g) ֮��Ĺ�ϵʽ��
��1��a=1��b=2��c=2 (��1�֣���3��)
��2��1120mL(2��) �� 2.5mol/L (2��) ��2Na2CO3��NaHCO3 ��2H2O (3��)
��3��0g<W��4.98g V=67200W/332 mL(��V=202.41WmL)
4.78g<W<12.45g V=1680��44800W/332 mL (��V=1680��134.94W mL)
W��12.45g V=0mL
��������
�����������1������2NaHCO3 Na2CO3+CO2��+H2O
���ԭ�����������֪n(CO2)��0.1 mol��
Na2CO3+CO2��+H2O
���ԭ�����������֪n(CO2)��0.1 mol��
2NaHCO3 Na2CO3+
CO2��+ H2O
Na2CO3+
CO2��+ H2O
2 1 1 1
0.2 mol 0.1 mol 0.1 mol 0.1 mol
m��NaHCO3��=0.2 mol��84 g��mol-1=16.8 g,���Ծ�����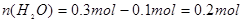 ��m��H2O��=0.2 mol��18 g��mol-1=3.6 g,m(Na2CO3)��31 g-16.8 g-3.6 g��10.6 g��
��m��H2O��=0.2 mol��18 g��mol-1=3.6 g,m(Na2CO3)��31 g-16.8 g-3.6 g��10.6 g��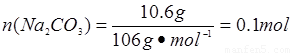 ���ɴ˿�֪������n(Na2CO3)��n(NaHCO3)��n(H2O)��0.1 mol��0.2 mol��0.2 mol��1��2��2�����Ծ��廯ѧʽΪNa2CO3��2NaHCO3��2H2O��
���ɴ˿�֪������n(Na2CO3)��n(NaHCO3)��n(H2O)��0.1 mol��0.2 mol��0.2 mol��1��2��2�����Ծ��廯ѧʽΪNa2CO3��2NaHCO3��2H2O��
��2����Na2CO3�����ᷴӦ�ֲ����С����ȷ�����Na2CO3+HCl=NaCl+ NaHCO3.��Na2CO3��ȫת��ΪNaHCO3����NaHCO3+HCl=NaCl+H2O+CO2����������ֻ����Na2CO3����ǰ���������ĵ��������ʵ�����ȡ���56����40��60ml���������������20mlʱ�������������1120ml,�ʼ���50mL����ʱ���������������10mlʱ����������������������560ml����Ϊ1120ml���ɱ������ݵ����������60��80ml����20mlʱ����������ֻ������840ml,˵����ʱ���������12.45��B��ȫ��Ӧ�ꡣ�������n(CO2)��2520/22.4=0.1125mol������20ml�����������1120ml����Ϊ0.5mol����ʱ�����ķ�ӦΪNaHCO3+HCl=NaCl+H2O+CO2������֪��������ʵ���Ϊ0.5mol����Ũ��Ϊ0.5/0.02= 2.5mol/L���������������40ml��Ӧ�������560ml�����з���������У�����ʣ�ࡣn(HCl)��0.1 mol,B��̼�������ʵ���Ϊx,��̼������Ϊ0.1125-x,��̼���Ʒ�Ӧ��������Ϊxmol����̼�����Ʒ�Ӧ������Ϊ0.1-x������0.1-x=0.025 x=0.075mol����̼��������Ϊ0.075*106=7.95g,̼������Ϊ0.1125-x=0.1125-0.075=0.0375mol,����Ϊ3.15g,ˮ������Ϊ1.35g,���ʵ���Ϊ0.075mol��n(Na2CO3)��n(NaHCO3)��n(H2O)��0.075mol��0.0375 mol��0.075mol��2��1��2��
��3������������Ȼ��ǡ����ȫ��Ӧ����CO2ʱ����Ȼ��2Na2CO3•NaHCO3•2H2O��Ħ������Ϊ332g•mol��1��ÿĦ����Ȼ����������5mol������Ʒ����Ϊ��(0.03��2.5��332)/5g��4.98g������Ʒ������Na2CO3ǡ��ת��ΪNaHCO3��û������CO2ʱ����Ʒ����Ϊ��(0.03��2.5��332)/2g��12.45g��Ȼ����0��m��4.98��4.98��m��12.45��1245��m�����������ۼ��㼴�ɡ�
���㣺���������غ㶨�ɡ�������ԭ��Ӧ����ʽ����д��̼����������ķֲ���Ӧ��֪ʶ��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� | |
| ����Һ�������mL�� | 30 | 30 | 30 | 30 |
| ��Ʒ��g�� | 3.32 | 4.15 | 5.81 | 7.47 |
| ������̼�������mL�� | 672 | 840 | 896 | 672 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� | |
| ����Һ�������mL�� | 30 | 30 | 30 | 30 |
| ��Ʒ��g�� | 3.32 | 4.15 | 5.81 | 7.47 |
| ������̼�������mL�� | 672 | 840 | 896 | 672 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
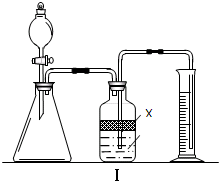 ʵ�����п�������ζ��ķ����ⶨNa2CO3��NaHCO3�ĺ������ⶨNa2CO3ʱ�����÷�̪��ָʾ������μ�����������Һ�ɺ�ɫ����ɫʱ��Na2CO3��ȫת��ΪNaHCO3���ⶨNaHCO3ʱ�����ü�����ָʾ������μ�����������Һ�ɻ�ɫ���ɫʱNaHCO3��ȫת��ΪCO2�ݳ���
ʵ�����п�������ζ��ķ����ⶨNa2CO3��NaHCO3�ĺ������ⶨNa2CO3ʱ�����÷�̪��ָʾ������μ�����������Һ�ɺ�ɫ����ɫʱ��Na2CO3��ȫת��ΪNaHCO3���ⶨNaHCO3ʱ�����ü�����ָʾ������μ�����������Һ�ɻ�ɫ���ɫʱNaHCO3��ȫת��ΪCO2�ݳ���| ʵ�鲽�� | ������� |
| ����٣�ȡ������Ʒ���Թ��У�������������ˮʹ֮�ܽ⣬ |
�а�ɫ�������ɣ�˵����Ʒ�к���NaC1 |
| ����ڣ���ȡ������Ʒ����ƿ�У�������������ˮʹ֮�ܽ⣬���뼸�η�̪����0.1000mol?L-1����ζ�����Һ�ɺ�ɫ����ɫ����¼������������Vl�� |
Ʒ�к���NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� |
������Һ�������mL�� | 30 | 30 | 30 | 30 |
��Ʒ��g�� | 3.32 | 4.15 | 5.81 | 7.47 |
������̼�������mL�� | 672 | 840 | 896 | 672 |
��1���ɵڢ��������е�CO2�������Ʒ����֮�ȣ������Ʋ���2.49 g��Ʒ����ͬ����ʵ��ʱ������CO2��������mL����״������
��2����ȡ3.32 g��Ȼ����Ʒ��300����ȷֽ�����ȫ��300��ʱNa2CO3���ֽ⣩������CO2112 mL����״������ˮ0.45 g�����㲢ȷ������Ȼ��Ļ�ѧʽ��
��3����֪Na2CO3��HCl��aq���ķ�Ӧ�������������У�
Na2CO3+HCl![]() NaCl+NaHCO3
NaCl+NaHCO3
NaHCO3+HCl![]() NaCl+CO2��+H2O
NaCl+CO2��+H2O
���ϱ��еڢ������ݿ���ȷ�����õ�HCl��aq����Ũ��Ϊ����mol/L��
��4�������ϱ����������Լ���Ȼ��Ļ�ѧʽ�����۲�ȷ������ʵ����CO2����״�������V��mL������Ʒ����W��g��֮��Ĺ�ϵʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com