
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,
(1))请写出NO2和CO反应的热 化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
则反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)⇌2N2O5(g);已知体系中n(NO2)随时间变化如表:
t(s) 0 500 1000 1500
N(NO2)(mol) 20 13.96 10.08 10.08
写出该反应的平衡常数表达式:K= ,
已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”).

考点: 热化学方程式;用盖斯定律进行有关反应热的计算;化学平衡常数的含义.
专题: 化学反应中的能量变化;化学平衡专题.
分析: (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368﹣134=234kJ,根据热化学方程式书写原则进行书写;然后根据盖斯定律来解答;
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热.
解答: 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368﹣134=234kJ,反应热化学方程式为:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=﹣234 kJ•mol﹣1 ①
又有N2(g)+2NO2(g)⇌4NO(g)△H=+292.3kJ•mol﹣1②
将2×①﹣②可得:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的△H=﹣760.3kJ/mol.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=﹣234 kJ•mol﹣1;﹣760.3kJ/mol;
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K= ;温度低,化学平衡常数大,则正反应放热,
;温度低,化学平衡常数大,则正反应放热,
故答案为: ;放热.
;放热.
点评: 本题考查盖斯定律的应用、化学平衡常数表达式的书写和计算以及平衡的移动等知识,题目难度不大.


科目:高中化学 来源: 题型:
下列实验装置设计正确,且能达到目的是()
A. 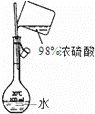
配制稀硫酸溶液
B. 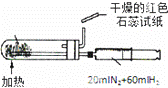
合成氨并检验氨的生成
C. 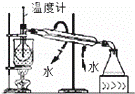
碘的CCl4溶液中分离I2并收回CCl4
D. 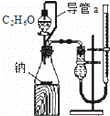
测定乙醇分子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 将AgCl放入水中不能导电,故AgCl不是电解质
B. CO2溶于水得到的溶液能导电,所以CO2是电解质
C. 金属能导电,所以金属是电解质
D. 固态的NaCl不导电,熔融态的NaCl能导电,NaCl是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4,用惰性电极电解此溶液,通电片刻,则氧化产物与还原产物的质量比为()
A. 8:1 B. 16:207 C. 71:2 D. 108:35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
国外新近研制的溴化锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液. 现有四个电极反应:①Zn﹣2e=Zn2+ ②Zn2++2e=Zn ③Br2+2e=2Br﹣ ④2Br﹣﹣2e=Br2.那么,充电时的阳极和放电时的负极反应分别是()
A. ④① B. ②③ C. ③① D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 78 gNa2O2晶体中所含阴阳离子个数均为2NA
B. 1.5 g CH3+中含有的电子数为NA
C. 3.4 g氨气分子中含有0.6NA个N﹣H键
D. 常温下,100 mL1 mol•L﹣1AlCl3溶液中Al3+离子总数等于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的检验说法正确的是( )
A. 将某气体通入品红溶液中,品红溶液褪色,加热后溶液恢复红色,则该气体一定是SO2
B. 钾元素焰色反应的操作:用铂丝蘸取氯化钾置于煤气灯的火焰上进行灼烧,直接观察其焰色
C. NH4+的检验:向待检液中加入NaOH溶液并加热,可生成使湿润的蓝色石蕊试纸变红的气体
D. 待检液加入盐酸可生成使澄清石灰水变浑浊的无色气体,则待检液中一定含有CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为( )
A. 1:1 B. 1:2 C. 3:4 D. 1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2mL 20
Ⅱ 2mL 20 10滴饱和MnSO4溶液
Ⅲ 2mL 30
Ⅳ 1mL 20 1mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为
(2)如果研究催化剂对化学反应速率的影响,使用实验 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验
(3)对比实验Ⅰ和Ⅳ,可以研究 学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com