
| A. | Na2O2-淡黄色固体,可用作漂白剂 | B. | Na2O-白色固体,溶于水生成NaOH | ||
| C. | NaOH-性质稳定,可治疗胃酸过多 | D. | NaHCO3-受热易分解,可用作发酵粉 |
分析 A.依据过氧化钠的颜色及过氧化钠的强氧化性解答;
B.氧化钠为白色固体,性质不稳定易与空气中的氧气、二氧化碳、水反应;
C.NaOH碱性太强,不能用于治疗胃酸过多;
D.碳酸氢钠不稳定,受热分解生成二氧化碳.
解答 解:A.过氧化钠为淡黄色固体,具有强的氧化性,可做漂白剂,故A正确;
B.氧化钠为白色固体,性质不稳定易与空气中的氧气、二氧化碳、水反应,所以溶于水生成NaOH,故B正确;
C.NaOH碱性太强,不能用于治疗胃酸过多,故C错误;
D.碳酸氢钠不稳定,受热分解生成二氧化碳,可以做发酵剂,故D正确;
故选:C.
点评 本题考查了元素化合物知识,明确钠及其化合物的性质是解题关键,注意碳酸氢钠碱性弱可用来治疗胃酸过多,受热易分解,可用作发酵粉,题目难度不大.


科目:高中化学 来源: 题型:解答题
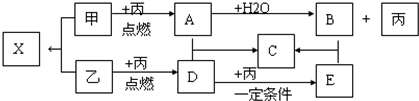
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,压强增大,平衡可能不移动 | |
| B. | 改变条件,A的转化率降低,平衡一定向正反应方向移动 | |
| C. | 只增大C的浓度,相当于加压,平衡向正反应方向移动 | |
| D. | 加入A,再次达平衡,C的体积分数可能降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有9个横行,分为7个周期 | B. | 有7个横行,分为7个周期 | ||
| C. | 有18个纵列,分为18个族 | D. | 有16个纵列,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
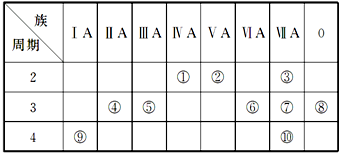
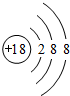 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com