
分析 烃的相对分子质量为114,则有114÷12=8…18,分子式为C8H18,为烷烃,一种同分异构体的一氯代物只有一种,则结构对称,只有一种H原子,另一种同分异构体,对应的单烯烃只有两种,说明C=C只有2种不同的位置,以此解答该题.
解答 解:烃的相对分子质量为114,则有114÷12=8…18,分子式为C8H18,为烷烃,一种同分异构体的一氯代物只有一种,则结构对称,只有一种H原子,结构简式为(CH3)3C-C(CH3)3,另一种同分异构体,对应的单烯烃只有两种,说明C=C只有2种不同的位置,该烷烃为(CH3)3C-CH2-CH(CH3)2,对应的烯烃为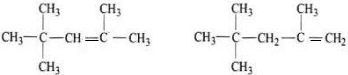 ,对应烯烃的名称为2,4,4-三甲基-1-戊烯、2,4,4-三甲基-2-戊烯,
,对应烯烃的名称为2,4,4-三甲基-1-戊烯、2,4,4-三甲基-2-戊烯,
故答案为:C8H18;烷;2,4,4-三甲基-1-戊烯、2,4,4-三甲基-2-戊烯.
点评 本题考查有机物的分子式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握有机物的同分异构体的判断,为考试热点,题目难度不大.


科目:高中化学 来源: 题型:填空题
 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 | B. | 0.10 | C. | 0.04 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.6 | B. | 13 | C. | 13.5 | D. | 13.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B位于元素周期表中第二周期第ⅥA族 | |
| B. | 工业上可以用电解CE溶液的方法同时获得C、E单质 | |
| C. | C、D的最高价氧化物对应的水化物之间能发生化学反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
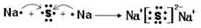 .其所含化学键类型为离子键.
.其所含化学键类型为离子键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①② | B. | ①④②③ | C. | ①③④② | D. | ④①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
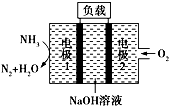
| A. | 电池工作时,电极2上发生氧化反应 | |
| B. | 电池工作一段时间后停止,溶液pH值比开始时明显增大 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com