

分析 (1)白色的硫酸铜遇到水变蓝,据此可检验是否有水生成;装置A中锌与稀盐酸反应生成硫酸锌和氢气,据此写出反应的化学方程式;装置D中氧化铜与氢气发生反应生成铜和水.
(2)根据氯化氢具有挥发性可知获得的氢气中混有氯化氢,需要用氢氧化钠溶液除去;氢气与氧化铜的反应需要加热,则氢气必须是干燥的;
(3)氢气不纯时会发生爆炸,需要先用制取的氢气赶走装置中空气.
解答 解:(1)白色的硫酸铜遇到水变蓝,所以E中白色粉末变蓝说明D中反应产物有H2O生成;装置A中锌与稀盐酸反应生成氢气,发生反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;装置D中氢气与氧化铜加热反应生成铜和水,反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,
故答案为:H2O;Zn+2HCl=ZnCl2+H2↑;H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(2)氯化氢具有挥发性,需要用氢氧化钠溶液除去,则装置B的作用是吸收稀盐酸挥发出的氯化氢气体;制取的氢气中混有水,由于氢气与氧化铜的反应需要加热,所以需要用浓硫酸干燥氢气,
故答案为:吸收稀盐酸挥发出的氯化氢气体;干燥H2;
(3)由于氢气不纯时会发生爆炸,则A装置中反应发生一段时间后,用生成的排尽试管内空气,再给装置D中药品加热,防止加热时,H2与空气混合发生爆炸,
故答案为:排尽试管内空气,防止加热时,H2与空气混合发生爆炸.
点评 本题考查了化学实验装置的综合应用,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握常见装置的构造及使用方法,试题培养了学生的化学实验能力.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐.碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(2007)第005号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封.避光.防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
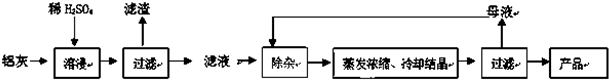
 海水的综合利用可以制备金属镁,其流程如图所示:
海水的综合利用可以制备金属镁,其流程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 部分结构和性质 |
| A | 所有元素中原子半径最小 |
| B | 次外层电子数为最外层电子数的一半 |
| C | 单质由双原子分子构成,分子中有14个电子 |
| D | 地壳中含量最高的元素 |
| E | 最高价氧化物对应的水化物能溶于强酸和强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温电解熔融氯化钠时,阴极得金属钠、阳极得氯气 | |
| B. | 工业电解饱和食盐水时,阴极区生成烧碱溶液和氢气、阳极得氯气 | |
| C. | 实验室用碳棒作电极电解氯化铜溶液时,在阴、阳极分别得到氯气和铜 | |
| D. | 镀锌时将两极材料浸入含锌离子的电解液中,锌棒接电源正极,待镀件接电源负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com