
【题目】VL浓度为0.5mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2VL
B.将溶液加热浓缩到0.5VL
C.加入10mol.L-1的盐酸0.1VL,再稀释至1.5VL
D.加入VL1.5mol.L-1的盐酸混合均匀
【答案】C
【解析】
A.根据c=![]() 计算判断;
计算判断;
B.加热时,盐酸会挥发;
C.根据c=![]() 计算判断;
计算判断;
D.根据浓稀盐酸混合后体积是否变化判断。
A.标准状况下的HCl气体11.2VL物质的量是0.5Vmol,向溶液中通入0.5VmolHCl,该溶液体积会增大,所以溶液浓度应该小于Vmol/L,A错误;
B.加热浓缩盐酸时,导致盐酸挥发增强,HCl的物质的量减少,B错误;
C.VL浓度为0.5molL-1的盐酸中溶质HCl的物质的量是0.5Vmol,10molL-1的盐酸0.1VL的HCl物质的量是Vmol,再稀释至1.5VL,所以c=![]() =
=![]() =1mol/L,C正确;
=1mol/L,C正确;
D.浓、稀盐酸混合后,溶液的体积不是直接求和,所以混合后溶液的物质的量浓度不是原来的2倍,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。利用常用的酸、碱和工业生产中的废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。
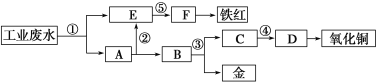
下列说法不正确的是( )
A.标号①②③处发生的反应均为氧化还原反应
B.标号③处加入的相应物质是稀硝酸或稀硫酸
C.标号①处发生的离子反应最多有三个
D.铁红的化学式为Fe2O3,工业上常用作红色颜料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出(溶液体积变化忽略不计),所得溶液Q中的![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 溶液Q比原溶液增重了1.92g.
B. Q中n(Cu2+):n(Fe3+)=3:4
C. 反应中转移的电子数为0.04mol
D. n(Cu2+)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O![]() NaOH + Cl2↑+ H2↑
NaOH + Cl2↑+ H2↑
(1)用双线桥表示出电子转移的方向和数目______________题干中反应改写成离子方程式是___________________________________
(2)电解食盐水的过程中,氧化产物是__________________________________
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___________________,________________________________.
(4)实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOH_______g。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为__________。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是___________(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列各组指定溶液中一定不能大量共存的离子组的个数是( )
①强酸性溶液中:Mg2+、K+、![]() 、
、![]()
②强碱性溶液中:Na+、Ba2+、![]() 、
、![]()
③在无色溶液中:H+、K+、![]() 、F-
、F-
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、![]() 、Cl-
、Cl-
⑤无色透明溶液中:![]() 、K+、Cl-、
、K+、Cl-、![]()
⑥无色透明的碱性溶液中:Na+、Ba2+、Cl-、![]()
A.一个B.两个C.三个D.四个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种有机物,它们的转化关系如图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.
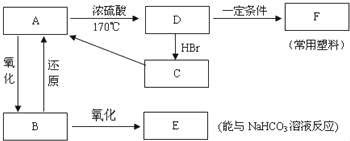
(1)A、B、C的结构简式分是 、 、 .
(2)B、C中所含官能团的名称分别是 、 .
(3)A到D的反应类型为 .
(4)C→A的反应条件是 .
(5)D→F反应的化学方程式是 .
(6)在一定的条件下,A与E反应可生成一种具有香味的物质.该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是
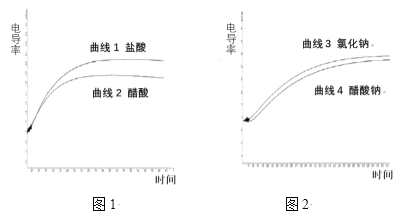
A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com