
| A. | $\frac{1}{2}$(10-9+10-11) mol•L-1 | B. | 2×10-11mol•L-1 | ||
| C. | (1×10-14-5×10-4) mol•L-1 | D. | (10-9+10-11) mol•L-1 |
分析 pH为9的NaOH溶液与pH为11的NaOH溶液等体积混合后,先计算出混合后溶液的c(OH-),再根据常温下水的离子积Kw计算出混合液中的c(H+).
解答 解:pH=9的NaOH溶液中c(OH-)=1×10-5mol/L,pH=11的NaOH溶液中c(OH-)=1×10-3mol/L,
两溶液混合后氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-5}+1{0}^{-3}}{2}$mol/L≈$\frac{1{0}^{-3}}{2}$mol/L,
则混合溶液中的氢离子浓度为:c(H+)=$\frac{1{0}^{-14}}{\frac{1{0}^{-3}}{2}}$mol/L=2.0×10-11mol/L,故选B.
点评 本题考查两种碱溶液混合后的溶液氢离子浓度计算,题目难题不大,注意解答时先计算混合液中c(OH-),再计算c(H+),为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 高炉炼铁、生产普通硅酸盐水泥和普通玻璃都要用到的原料是石灰石 | |
| B. | 用电解饱和食盐水的方法制备金属钠 | |
| C. | 通常用海水提取食盐后的母液为原料制取溴单质 | |
| D. | 利用焦炭在高温下还原二氧化硅可制备粗硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 广泛pH试纸和精密pH试纸测量的精密度不同,测量的范围相同 | |
| B. | 用NaOH标准溶液滴定CH3COOH溶液至中性时,溶液中的酸未被完全中和 | |
| C. | 将等体积等物质的量浓度的弱酸HA与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | |
| D. | 等物质的量的NaClO、NaHCO3混合溶液中存在如下关系:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用 | |
| B. | 氢硫酸是弱酸,不能与强酸盐反应生成强酸 | |
| C. | 稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应 | |
| D. | 硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生反应:SO3+H2O+BaCl2═BaSO4↓+2HCl | |
| B. | 产生蓝色沉淀 | |
| C. | 有气体生成 | |
| D. | 若将SO2通入BaCl2溶液中,也会产生与SO3通入BaCl2溶液中相同的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,在水中的溶解度:Na2CO3<NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 都能与足量盐酸反应放出CO2,且产生气体的物质的量相同 | |
| D. | 与相同浓度的盐酸反应放出CO2的速率Na2CO3大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有还原性 |
| B | 将FeSO4样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | FeSO4样品已氧化变质 |
| C | 将新制氯水和KBr溶液在试管中混合后,加入苯酚,振荡静置 | 溶液分层,下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 分别向0.1mol•L-1酸酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 酸酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
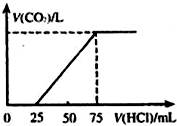 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com