
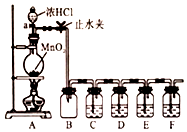
 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:分析 装置A是发生装置,利用二氧化锰和浓盐酸加热反应生成氯气,装置中盛有的药品依次是C:饱和食盐水用来吸收氯化氢,D:1.0mol/LFeI2,和氯气反应生成碘单质、铁离子,碘单质遇到淀粉变蓝色、铁离子遇到KSCN混合溶液变红色,通过E:1.0mol/LFeBr2、KSCN、CCl4混合物,上层液体先变红色,一段时向后下层液体再变橙色,最后通过装置F吸收多余的氯气,防止污染空气,
(1)装置是气体发生和气体性质验证,实验前需要检验装置气密性,利用装置内压强变化和最后导气管在水中冒泡和水柱上升情况分析;
(2)F中是氢氧化钠溶液用来吸收多余的氯气
(3)D中溶液先由浅绿色变为蓝色,说明碘离子先被氧化为碘单质,I-离子还原性大于Fe2+;
(4)E中是1.0mol/LFeBr2、KSCN、CCl4混合物,若现察到E中上层液体先变红色,一段时向后下层液体再变橙色,说明亚铁离子还原性大于溴离子;
(5)D中是1.0mol/L FeI2,淀粉、KSCN混合溶液,通入氯气D中溶液颜色褪去最终变黄是碘单质被氯气也会为碘酸;
(6)卤素互化物(如氯化溴)易与水反应.
解答 解:装置A是发生装置,利用二氧化锰和浓盐酸加热反应生成氯气,装置中盛有的药品依次是C:饱和食盐水用来吸收氯化氢,D:1.0mol/LFeI2,和氯气反应生成碘单质、铁离子,碘单质遇到淀粉变蓝色、铁离子遇到KSCN混合溶液变红色,通过E:1.0mol/LFeBr2、KSCN、CCl4混合物,上层液体先变红色,一段时向后下层液体再变橙色,最后通过装置F吸收多余的氯气,防止污染空气,
(1)加入药品前必须要进行的操作是检查装置气密性,方法是关闭分液漏斗活塞,将末端导管口置于水中,微热烧瓶,
故答案为:检查装置气密性;关闭分液漏斗活塞,将末端导管口置于水中,微热烧瓶;
(2)氯气有毒,不能排放到空气中,F中加入的药品是氢氧化钠溶液,作用是吸收尾气中的氯气,防止污染空气,
故答案为:氢氧化钠溶液;吸收尾气中的氯气,防止污染空气;
(3)D中溶液先由浅绿色变为蓝色,说明碘离子先被氧化为碘单质,I-离子还原性大于Fe2+,证明Fe3+氧化性比I2强,
故答案为:蓝;
(4)E中是1.0mol/LFeBr2、KSCN、CCl4混合物,若现察到E中上层液体先变红色说明亚铁离子被也会为铁离子,结合SCN-离子形成血红色溶液,一段时向后下层液体再变橙色是溴离子被也会为溴单质,说明亚铁离子还原性大于溴离子,证明溴单质氧化性大于Fe3+离子,
故答案为:Br2;Fe3+;
(5)①(SCN)2的性质与卤素相似,氧化性为Cl2>(SCN)2,②在水溶液中,氯气可将碘氧化生成+5价的化合物,D中是1.0mol/L FeI2,淀粉、KSCN混合溶液,通入氯气,氯气氧化SCN-为(SCN)2,D中溶液颜色褪去最终变黄是碘单质被氯气也会为碘酸,反应的离子方程式为:5Cl2+I2+6H2O=12H++10Cl-+2IO3-,
故答案为:Cl2+2SCN-=2Cl-+(SCN)2;5Cl2+I2+6H2O=12H++10Cl-+2IO3-;
(6)卤素互化物(如氯化溴)易与水反应,发生的是复分解反应,反应的化学方程式为:BrCl+H2O=HBrO+HCl,
故答案为:BrCl+H2O=HBrO+HCl.
点评 本题考查了物质性质的实验验证、反应现象、微粒氧化性的实验验证方法、信息读取和应用,掌握基础是解题关键,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{71ρ}{32}$g•L-1 | B. | $\frac{32ρ}{71}$g•L-1 | C. | $\frac{32}{71ρ}$g•L-1 | D. | $\frac{71}{32ρ}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-3-丁烷 | B. | 2,2-二甲基-2-丁烯 | ||
| C. | 2,2-二甲基-1-丁烯 | D. | 2,2-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1molN2在一定条件下反应所得混合气体分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
下列实验操作中,所用仪器合理的是( )
A. 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体
B. 用10 mL的量筒量取4.8 mL的盐酸
C. 用托盘天平称取25.20 g NaCl
D. 用1000 mL容量瓶配制450 mL 0.1 mol·L-1的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com