
分析 (1)醋酸为弱电解质,不能完全电离,若稀释后溶液pH相等,则盐酸稀释体积大于醋酸;
(2)一水合氨为弱电解质,溶液中部分电离,稀释后氨水中氢氧根离子的物质的量增大,氢氧化钠溶液中氢氧根离子的物质的量不变,据此分析;
(3)硫酸钠溶液是显中性的,根据稀释原理来计算回答;
(4)混合液的pH=2,酸过量,根据反应后溶液的组成分析各种离子的浓度大小;
(5)硫酸铵溶液中铵根离子水解显酸性,水解微弱,铵根离子浓度大于硫酸根离子.
解答 解:(1)醋酸为弱电解质,不能完全电离,若浓度均为0.2mol•L-1、等体积的盐酸和CH3COOH溶液分别加水稀释m倍、n倍,溶液的pH相同,即溶液中氢离子浓度相等,则盐酸稀释的倍数大于醋酸,即m>n,故答案为:m>n;
(2)一水合氨为弱电解质,溶液中部分电离出氢氧根离子,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,稀释相同的倍数后,氨水的pH大于氢氧化钠溶液的,分别加水稀释m倍、n倍,溶液的pH都变成9,所以氨水稀释的倍数大,故答案为:m>n;
(3)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1;
(4)混合液的pH=2,酸过量,c(H+)=c(H+)=$\frac{0.1{V}_{2}-0.1{V}_{1}}{{V}_{1}+{V}_{2}}$=0.01,解之得:$\frac{{V}_{1}}{{V}_{2}}$=9:11,c(Na+)=0.045mol/L,c(SO42-)=0.0275mol/L,c(H+)=0.01mol/L硫酸过量溶液显酸性,c 则(H+)>c (OH-),故溶液中各种离子的浓度由大到小的排列顺序是:c (Na+)>c (SO42-)>c (H+)>c (OH-),故答案为:c (Na+)>c (SO42-)>c (H+)>c (OH-),
(5)溶液中铵根离子水解显酸性,水解微弱,铵根离子浓度大于硫酸根离子,溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-).
点评 本题考查了强弱电解质在稀释时的离子浓度变化、盐类水解、离子浓度大小比较的分析应用,注意pH相等就是电离出来的氢离子或氢氧根离子浓度相等,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时.将电能转化成化学能 | |
| B. | 充电时,阳极反应为Li++e-═Li | |
| C. | 正极的电极反应式为FeS2+2e-+2Li+═Li2FeS2 | |
| D. | 每转移0.1mol电子,正极材料消耗12.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3.请回答下列问题:
SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
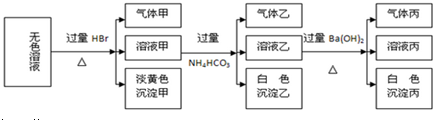
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 两种不同的非金属元素形成的化合物中只存在极性共价键 | |
| C. | 共价化合物不可能存在离子键 | |
| D. | 某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、OH-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Cu2+、Mg2+、CO32-、Cl- | D. | H+、Na+、MnO4-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1mol•L-1NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=+57.3 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com