
| A£® | “¦Ąķ¹ż³ĢÖŠŅųĘ÷Ņ»Ö±±£³ÖŗćÖŲ | |
| B£® | Õż¼«µÄµē¼«·“Ó¦ĪŖAg2S-2e-ØT2Ag++S | |
| C£® | øĆ¹ż³ĢÖŠĀĮŹĒøŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦ | |
| D£® | ŗŚÉ«ĶŹČ„µÄŌŅņŹĒŗŚÉ«Ag2S×Ŗ»ÆĪŖ°×É«AgCl |
·ÖĪö ĀĮ”¢ŅųŗĶĀČ»ÆÄĘČÜŅŗ¹¹³ÉŌµē³Ų£¬ĀĮ×÷øŗ¼«”¢Ņų×÷Õż¼«£¬øŗ¼«ÉĻĀĮŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«ÉĻŅųĄė×ӵƵē×Ó·¢Éś»¹Ō·“Ó¦£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗA£®ŅųĘ÷·ÅŌŚĀĮÖĘČŻĘ÷ÖŠ£¬ÓÉÓŚĀĮµÄ»īĘĆŠŌ“óÓŚŅų£¬¹ŹĀĮĪŖøŗ¼«£¬Ź§µē×Ó£¬ŅųĪŖÕż¼«£¬Ņų±ķĆęµÄAg2SµĆµē×Ó£¬Īö³öµ„ÖŹŅų£¬ĖłŅŌŅųĘ÷ÖŹĮæ¼õŠ”£¬¹ŹA“ķĪó£»
B£®Õż¼«ŅųĄė×ӵƵ½µē×ÓÉś³ÉŅųµ„ÖŹ£¬Õż¼«·“Ó¦Ź½ĪŖ£ŗAg++e”śAg£¬¹ŹB“ķĪó£»
C£®AlĪŖøŗ¼«£¬·“Ó¦ÖŠŹ§Č„µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬¹ŹCÕżČ·£»
D£®ŗŚÉ«ĶŹČ„ŹĒAg2S×Ŗ»ÆĪŖAg¶ų²»ŹĒAgCl£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éĮĖŌµē³Ų¹¤×÷ŌĄķ¼°ĘäÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·Ōµē³Ų¹¤×÷ŌĄķĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕŌµē³ŲĮ½¼«µÄÅŠ¶Ļ·½·Ø£¬Äܹ»ÕżČ·ŹéŠ“µē¼«·“Ó¦Ź½£¬ŹŌĢāÅąŃųĮĖѧɜµÄĮé»īÓ¦ÓĆÄÜĮ¦£®


 ¾«Ó¢æŚĖćæØĻµĮŠ“š°ø
¾«Ó¢æŚĖćæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.25 | B£® | 0.1 | C£® | 0.5 | D£® | 0.05 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | x£¼y | B£® | x=y | C£® | x£¾y | D£® | ĪŽ·ØČ·¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
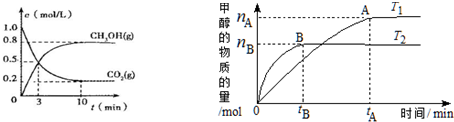
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
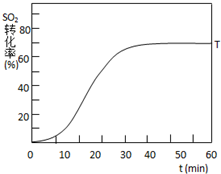 øł¾Żµ±µŲ׏Ō“µČĒéæö£¬ĮņĖį¹¤Ņµ³£ÓĆ»ĘĢśæó£ØÖ÷ŅŖ³É·ÖĪŖFeS2£©×÷ĪŖŌĮĻ£®
øł¾Żµ±µŲ׏Ō“µČĒéæö£¬ĮņĖį¹¤Ņµ³£ÓĆ»ĘĢśæó£ØÖ÷ŅŖ³É·ÖĪŖFeS2£©×÷ĪŖŌĮĻ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
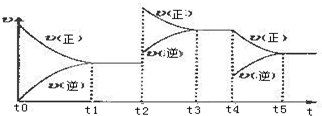
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
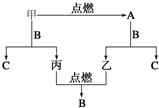 ¼×”¢ŅŅ”¢±ūČżÖÖ³£¼ūµ„ÖŹ£¬A”¢B”¢CŹĒČżÖÖ³£¼ūµÄ»ÆŗĻĪļ£¬AĪŖµ»ĘÉ«¹ĢĢ壬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®
¼×”¢ŅŅ”¢±ūČżÖÖ³£¼ūµ„ÖŹ£¬A”¢B”¢CŹĒČżÖÖ³£¼ūµÄ»ÆŗĻĪļ£¬AĪŖµ»ĘÉ«¹ĢĢ壬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
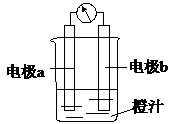 æĪĢĆѧĻ°ÖŠ£¬Ķ¬Ń§ĆĒĄūÓĆĆ¾Ģõ”¢Šæʬ”¢Ķʬ”¢µ¼Ļß”¢µēĮ÷¼Ę”¢³ČÖ”¢ÉÕ±µČÓĆĘ·Ģ½¾æŌµē³ŲµÄ×é³É£®ĻĀĮŠ½įĀŪ²»ÕżČ·µÄŹĒ£Ø””””£©
æĪĢĆѧĻ°ÖŠ£¬Ķ¬Ń§ĆĒĄūÓĆĆ¾Ģõ”¢Šæʬ”¢Ķʬ”¢µ¼Ļß”¢µēĮ÷¼Ę”¢³ČÖ”¢ÉÕ±µČÓĆĘ·Ģ½¾æŌµē³ŲµÄ×é³É£®ĻĀĮŠ½įĀŪ²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | Ōµē³ŲŹĒ½«»ÆѧÄÜ×Ŗ»Æ³ÉµēÄܵÄ×°ÖĆ | |
| B£® | Ōµē³ŲÓɵē¼«”¢µē½āÖŹČÜŅŗŗĶµ¼ĻßµČ×é³É | |
| C£® | ÓŅĶ¼ÖŠa¼«ĪŖĆ¾Ģõ”¢b¼«ĪŖŠæʬŹ±£¬µ¼ĻßÖŠ»į²śÉśµēĮ÷ | |
| D£® | ÓŅĶ¼ÖŠa¼«ĪŖŠæʬ”¢b¼«ĪŖĶʬŹ±£¬µē×ÓÓÉĶʬĶعżµ¼ĻßĮ÷ĻņŠæʬ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com