
| A. | 加水,它的溶度积减小、溶解度增大 | |
| B. | 升高温度,它的溶解度和溶度积都增大 | |
| C. | 饱和溶液中c(Am+)=c(Bn-) | |
| D. | 加水,它的溶度积、溶解度均不变 |
分析 A.溶度积与温度有关,与浓度无关;
B.大多数难溶电解质溶解平衡吸热,而氢氧化钙的溶解平衡为放热;
C.由AnBm(s)?nAm+(aq)+mBn-(aq)可知离子浓度关系;
D.溶度积、溶解度均与温度有关,且溶解度与一定量的溶剂有关.
解答 解:A.溶度积与温度有关,与浓度无关,则加水,它的溶度积、溶解度均不变,故A错误;
B.大多数难溶电解质溶解平衡吸热,而氢氧化钙的溶解平衡为放热,则升高温度,它的溶解度和溶度积可能增大或减小,故B错误;
C.由AnBm(s)?nAm+(aq)+mBn-(aq)可知离子浓度为mc(Am+)=nc(Bn-),故C错误;
D.溶度积、溶解度均与温度有关,且溶解度与一定量的溶剂有关,则加水,它的溶度积、溶解度均不变,故D正确;
故选D.
点评 本题考查难溶电解质,为高频考点,把握溶解平衡移动、Ksp的影响因素为解答的关键,侧重分析与应用能力的考查,注意选项B中温度越高氢氧化钙的溶解度越小,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化时要吸收大量的热,可用作制冷剂 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | SO2具有氧化性,可用于漂白纸浆 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
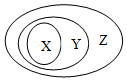 用如图表示的一些物质或概念间的从属关系中,正确的是( )
用如图表示的一些物质或概念间的从属关系中,正确的是( ) | X | Y | Z | |
| A | 非金属单质 | 非电解质 | 纯净物 |
| B | 置换反应 | 氧化还原反应 | 离子反应 |
| C | 胶体 | 分散系 | 混合物 |
| D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com