
【题目】某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
阳离子 | K+、Ba2+、Ag+、Mg2+、NH |
阴离子 | Cl-、SO |
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12,实验中未嗅到刺激性气味。则混合物组成中肯定不存在的离子是________。
(2)向(1)所得溶液中滴加盐酸,有沉淀生成,同时有无色无味气体逸出。则肯定存在的离子是___,可以排除的离子是________。
(3)取(2)实验后的上层清液,滴加AgNO3溶液,有白色沉淀生成。思考还有没有离子尚待检验?请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论): ________。如果认为没有尚待检验的离子,此空不填。
【答案】MnO![]() 、NH
、NH![]() 、Ag+、Mg2+ SiO
、Ag+、Mg2+ SiO![]() 、CO
、CO![]() 、K+ Ba2+、SO
、K+ Ba2+、SO![]() 取(1)中所得溶液少许于试管中,用硝酸酸化后滴加AgNO3溶液,若有白色沉淀生成则含有Cl-,否则不含Cl-
取(1)中所得溶液少许于试管中,用硝酸酸化后滴加AgNO3溶液,若有白色沉淀生成则含有Cl-,否则不含Cl-
【解析】
(1)取该粉末,加水后固体完全溶解得到无色溶液,说明没有MnO![]() ,用pH试纸测得溶液的pH为12,溶液呈碱性,Ag+ Mg2+离子不能存在,且未嗅到气味,证明原溶液中无铵根离子;
,用pH试纸测得溶液的pH为12,溶液呈碱性,Ag+ Mg2+离子不能存在,且未嗅到气味,证明原溶液中无铵根离子;
(2)向(1)所得溶液中滴加盐酸溶液,有沉淀生成,说明含有SiO![]() ,同时有无色无味气体逸出,证明含CO32-,不存在Ba2+、SO32-,结合电荷守恒分析判断;
,同时有无色无味气体逸出,证明含CO32-,不存在Ba2+、SO32-,结合电荷守恒分析判断;
(3)取(2)实验后的上层清液,滴加AgNO3溶液,有白色沉淀生成,说明(2)实验后的上层清液中含有Cl-,结合实验步骤分析判断。
(1)取该粉末,加水后固体完全溶解得到无色溶液,说明没有MnO![]() ,用pH试纸测得溶液的pH为12,溶液呈碱性,Ag+ Mg2+离子不能存在,且未嗅到气味,证明原溶液中无铵根离子;由此可推出肯定不存在的离子为NH4+、Ag+、Mg2+,故答案为:MnO
,用pH试纸测得溶液的pH为12,溶液呈碱性,Ag+ Mg2+离子不能存在,且未嗅到气味,证明原溶液中无铵根离子;由此可推出肯定不存在的离子为NH4+、Ag+、Mg2+,故答案为:MnO![]() 、NH4+、Ag+、Mg2+;
、NH4+、Ag+、Mg2+;
(2)向(1)所得溶液中滴加盐酸溶液,有沉淀生成,说明含有SiO![]() ,同时有无色无味气体逸出,证明含CO32-,则一定不存在Ba2+;SO32-离子与酸反应生成无色刺激性气味的气体,一定不含有SO32-,溶液中至少存在一种阳离子,则一定含有K+,则肯定存在的离子是SiO
,同时有无色无味气体逸出,证明含CO32-,则一定不存在Ba2+;SO32-离子与酸反应生成无色刺激性气味的气体,一定不含有SO32-,溶液中至少存在一种阳离子,则一定含有K+,则肯定存在的离子是SiO![]() 、CO
、CO![]() 、K+,可以排除的离子是Ba2+、SO
、K+,可以排除的离子是Ba2+、SO![]() ,故答案为:SiO
,故答案为:SiO![]() 、CO
、CO![]() 、K+;Ba2+、SO32-;
、K+;Ba2+、SO32-;
(3)取(2)实验后的上层清液,滴加AgNO3溶液,有白色沉淀生成,说明(2)实验后的上层清液中含有Cl-,但(2)中加入盐酸时会引入Cl-,不能说明原溶液中是否存在Cl-。要验证Cl-的存在,可以取(1)中所得溶液少许于试管中,用硝酸酸化后滴加AgNO3溶液,若有白色沉淀生成则含有Cl-,否则不含Cl-,故答案为:取(1)中所得溶液少许于试管中,用硝酸酸化后滴加AgNO3溶液,若有白色沉淀生成则含有Cl-,否则不含Cl-。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在恒容的密闭容器中,发生aA(g) + bB(g) ![]() hH(g),达到平衡后,A、B、H的物质的量分别为a mol、b mol、h mol。已知a + b = 2h,若保持温度不变,将三者的物质的量扩大一倍,则下列判断正确的是
hH(g),达到平衡后,A、B、H的物质的量分别为a mol、b mol、h mol。已知a + b = 2h,若保持温度不变,将三者的物质的量扩大一倍,则下列判断正确的是
A. 达到平衡时,混合气体的密度不变
B. 平衡后b mol/L < c(B) < 2b mol/L
C. 达到平衡时,气体A的质量分数减小
D. 若其他条件不变,将容器改为恒压,则平衡后H的体积分数大于1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。请回答下列问题:

(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______________。
(3)一个晶胞的体积是____________。
(4)金晶体的密度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:

(1)A的名称是__________,B中含碳官能团的结构式为__________。
(2)反应③的有机反应类型是__________。
(3)下列说法正确的是(_____)
A. 1mol E与足量的新制氢氧化铜悬浊液反应能生成1molCu2O
B. F能与NaHCO3反应产生CO2
C. 反应①发生的是消去反应
(4)写出E与银铵溶液反应的化学方程式________________________________________。
(5)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有_______种;请写出其中任意两种________________________________________________。
的同分异构体中同时符合下列条件的芳香族化合物共有_______种;请写出其中任意两种________________________________________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(6)写出反应⑤的化学方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
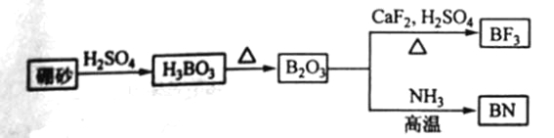
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__(填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________.
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):

①H、O、N三种元素的电负性从大到小的顺序____。
②乙二胺分子中N原子成键时采取的杂化类型是__。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯水的叙述,正确的是( )
A.新制氯水中的微粒在只有Cl2和H2O分子
B.氯水放置数天后酸性不变
C.新制氯水可使蓝色石蕊试纸先变红后褪色
D.光照氯水有气泡放出,该气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com