
【题目】A~G都是有机化合物,它们的转化关系如下:

请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气对氢气的相对密度为30,则E的分子式为_______________。
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为 。
(3)由B生成D、由C生成D的反应条件分别是_______________、_______________。
(4)由A生成B、由D生成G的反应类型分别是_______________、_______________。
(5)F存在于栀子香油中,其结构简式为_______________。
![]() 【答案】(1) C2H4O2 (2)
【答案】(1) C2H4O2 (2)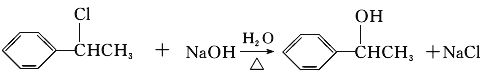
(3)NaOH的醇溶液,加热;浓硫酸,加热
(4)取代反应,加成反应 (5)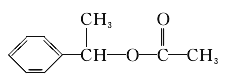
【解析】
试题分析:(1)E蒸气的密度标准状况下约为2.68g/L,则E的摩尔质量=22.4×2.68=60g/mol,6.0gE的物质的量是0.1mol,完全燃烧后生成8.8 g CO2和3.6g H2O,物质的量分别为0.2mol、0.2mol,则分子中N(C)=2、N(H)=4,故N(O)=(60-24-4)/16=2,所以E的分子式是C2H4O2;
(2)A为一取代芳香烃,由分子式C8H10可知为苯的同系物,故A为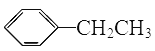 ,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,则B为
,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,则B为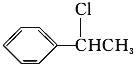 ,B发生水解反应生成C为
,B发生水解反应生成C为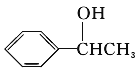 ,由B生成C的化学方程式为
,由B生成C的化学方程式为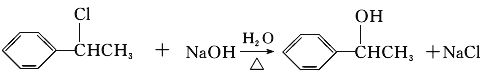 ;
;
(3)C与E发生反应生成F,结合F的分子式可知,应是发生酯化反应,则E为CH3COOH,F为 ,B、C转化都得到D,D与溴发生加成反应生成G,则B、C均发生消去反应生成D,故D为
,B、C转化都得到D,D与溴发生加成反应生成G,则B、C均发生消去反应生成D,故D为![]() ,则G为
,则G为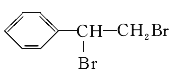 ,所以由B生成D的反应条件是NaOH醇溶液、加热;由C生成D的反应条件是浓硫酸、加热;
,所以由B生成D的反应条件是NaOH醇溶液、加热;由C生成D的反应条件是浓硫酸、加热;
(4)根据以上分析可知由A生成B是取代反应,由D生成G是加成反应;
(5)由上述分析可知F的结构简式为 。
。


科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
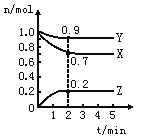
(1)该反应的化学方程式为 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均分子量比起始投料时_______ _____(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为______________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )。
A.CH2Cl2有 两种结构
两种结构
B.烯烃跟氢气起加成反应产物是2,2,3,4-四甲基戊烷,则这样的烯烃有3种
C. 的一氯代物有5种
的一氯代物有5种
D.1 mol某烷烃完全燃烧消耗11 mol O2,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。
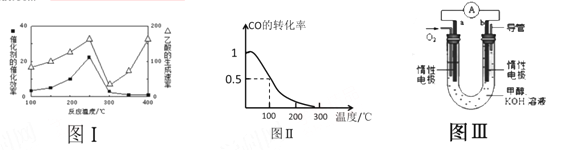
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。(填序号)
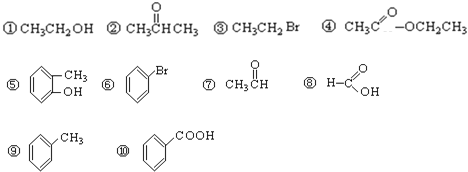
(1)芳香烃:__________; (2)卤代烃:__________;
(3)醇:__________; (4)酚:__________;
(5)醛:__________; (6)酮:__________;
(7)羧酸:__________;(8)酯:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象 ;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 ;
(3)MnO2加入双氧水中放出气泡更快 .
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
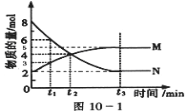
(1)比较t2时刻,正逆反应速率大小V正 V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为: .
(3)t3时刻化学反应达到平衡,反应物的转化率为 .
(4)如果升高温度,则V逆 (填增大、减小或不变).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com