
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
分析 A.根据v=$\frac{△c}{△t}$计算500s内N2O5分解速率;
B.1000s、1500s时,N2O5的浓度都是2.5mol/L,说明1000s时反应到达平衡,利用三段式计算平衡时各组分的浓度、各物质的浓度变化量,代入平衡常数表达式K=$\frac{{c}^{4}(N{O}_{2})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$计算,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%;
C.该反应正反应是吸热反应,升高温度,平衡向正反应移动,平衡时时N2O5(g)浓度应降低;
D.平衡常数只受温度影响,该反应正反应是吸热反应,升高温度,平衡向正反应移动,化学平衡常数增大.
解答 解:A.500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5分解速率为$\frac{1.48mol/L}{500s}$=2.96×10-3mol/(L•s),故A正确;
B.1000s、1500s时,N2O5的浓度都是2.5mol/L,说明1000s时反应到达平衡,则:
2N2O5(g)?4NO2(g)+O2(g)
开始(mol/L):5 0 0
变化(mol/L):2.5 5 1.25
平衡(mol/L):2.5 5 1.25
故该温度下,平衡常数k=$\frac{{5}^{4}×1.25}{2.{5}^{2}}$=125,N2O5的转化率=$\frac{2.5mol/L}{5mol/L}$×100%=50%,故B正确;
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5mol/L,平衡向逆反应方向移动,正反应为吸热反应,应为降低温度,故T1>T2,故C错误;
D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,说明T2温度与T1温度相比,平衡向逆反应方向移动,正反应为吸热反应,应降低温度,则T1>T2,故D正确.
故选C.
点评 本题考查化学反应速率计算、化学平衡影响因素、化学平衡平衡常数计算及影响因素等,难度中等,注意理解掌握外界条件对平衡移动的影响.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
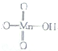 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的二元取代物无同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质 | B. | 非金属单质 | C. | 可溶性碱 | D. | 可溶性盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com