
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量 | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________对反应速率有影响,______________反应速率越快,能表明同一规律的实验还有__________(填实验序号);
(2)实验1、3、4、6、8表明反应物浓度对反应速率产生影响,能表明同一规律的实验还有______________(填实验序号);
(3)本实验中影响反应速率的其他因素还有________,其实验序号是6和________,8和__________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:____________________________________________。
科目:高中化学 来源: 题型:
(1)若5.2g乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ。该反应的热化学方程式为 ;
乙炔的燃烧热为 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
__________________________________________________________________________。
(3)已知:
2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1
则Al和FeO发生铝热反应的热化学方程式为:
__________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是 ( )

A.石墨Ⅰ极为正极,石墨Ⅱ极为负极
B.Y的化学式可能为NO
C.石墨Ⅰ极的电极反应式为NO2+NO -e-===N2O5
-e-===N2O5
D.石墨Ⅱ极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的7/10,则下列说法中不正确的是
| X | Y | |
| Z | W |
A.原子半径由大到小排列顺序Z>Y>X
B.Y元素的两种同素异形体在常温下都是气体
C.最高价氧化物对应水化物的酸性W>Z
D.阴离子半径由大到小排列顺序Z>W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子 数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。
数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。
请回答下列问题:
(1)元素B在周期表中的位置是_____________________,元素D的原子结构示意图为____ ____。
(2)A2C比A2E沸点高的原因是________________________________________________。
(3)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为________________________,负极的电极反应式为______________________,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(4)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环 境无污染。1 mol B2A4与B2C4完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为________________________________________________________________。
境无污染。1 mol B2A4与B2C4完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质状态发生变化时,所克服的微粒间作用力完全相同的是
A.碘的升华和干冰气化 B.二氧化硅和干冰熔化
C.苯和硝酸钾熔化 D.食盐的熔化和冰的融化
查看答案和解析>>
科目:高中化学 来源: 题型:
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H+ + 2e- == H2↑,O2 + 4e- + 4H+ == 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
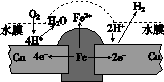
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①A是石油分解的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2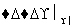 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
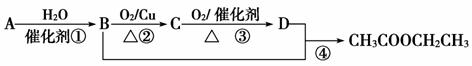
回答下列问题:
(1)写出A的结构式_________________;C的结构简式______________________;
(2)B、D分子中的官能团分别是________________、_________________。
(3)写出下列反应的反应类型:①_______________,②_______________,④________________。
(4)写出下列反应的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________;
④________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com