
【题目】苯佐卡因是人类合成的第一种麻醉药,从此人类摆脱了麻醉药依赖天然植物的历史。下面是苯佐卡因的一种合成路线:

回答下列问题:
(1)物质B的结构简式为_______________,物质C的结构简式为 __________________。
(2)反应②的反应类型为______________,反应③的反应类型为 __________________。
(3)反应①的化学方程式为 ____________________________________________;反应④的化学方程式为____________________________________________。
(4)苯佐卡因的核磁共振氢谱中有____________个峰。
(5)苯佐卡因有多种同分异构体,除苯佐卡因外,符合下列条件的共有 _______种。
①含苯环且氨基直接与苯环相连;②苯环上有两个取代基;③含酯基
其中能与NaOH溶液反应生成2种钠盐的同分异构体的结构简式为:____________。(任写一种)
【答案】![]()
 氧化反应酯化反应或取代反应
氧化反应酯化反应或取代反应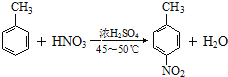
![]() +CH3CH2OH
+CH3CH2OH![]()
 +H2O517
+H2O517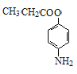 、
、 、
、
【解析】
根据题中各物转化关系,结合E的结构可知,甲苯发生硝化反应生成B为![]() ,B发生氧化反应生成C为
,B发生氧化反应生成C为 ,C发生还原反应生成D为
,C发生还原反应生成D为![]() ,D发生酯化反应生成E,据此答题。
,D发生酯化反应生成E,据此答题。
根据题中各物转化关系,结合E的结构可知,甲苯发生硝化反应生成B为![]() ,B发生氧化反应生成C为
,B发生氧化反应生成C为 ,C发生还原反应生成D为
,C发生还原反应生成D为![]() ,D发生酯化反应生成E,(1)根据上面的分析可知,B为
,D发生酯化反应生成E,(1)根据上面的分析可知,B为![]() ,C为
,C为 ;
;
(2)反应②的反应类型为氧化反应,反应④的反应类型为酯化反应,也属于取代反应;
(3)反应①为甲苯在浓硫酸催化下与浓硝酸发生硝化反应生成对硝基甲苯,反应的化学方程式为 ;反应④为
;反应④为![]() 与乙醇在浓硫酸催化下发生酯化反应生成苯佐卡因和水,反应的化学方程式为
与乙醇在浓硫酸催化下发生酯化反应生成苯佐卡因和水,反应的化学方程式为![]() +CH3CH2OH
+CH3CH2OH![]()
 +H2O;
+H2O;
(4)根据苯佐卡因 的结构简式可知,其核磁共振氢谱中有5个峰;
的结构简式可知,其核磁共振氢谱中有5个峰;
(5)根据条件①含苯环且氨基直接与苯环相连;②苯环上有两个取代基;③含酯基,符合条件的苯佐卡因的同分异构体为苯环连有-NH2和-C3H5O2基团,-C3H5O2基团且是酯基的结构有-OOCCH2CH3、-CH2OOCCH3、-CH2CH2OOCH、-CH(CH3)OOCH、-COOCH2CH3、-CH2COOCH3,它们与氨基都有互为邻、间、对三种位置位置关系,所以共有18种结构,除了苯佐卡因外,有17种,其中能与NaOH溶液反应生成2种钠盐的同分异构体的结构简式为 、
、 、
、 。
。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】某芳香烃A分子式为C8H10,它的主要用途是在石油化学工业作为生产苯乙烯的中间体,所制成的苯乙烯一般被用来制备常用的塑料制品——聚苯乙烯。某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色。J分子内有两个互为对位的取代基。在一定条件下各物质间有如下的转化关系:(无机物略去)

(1)A物质的名称为__________。写出核磁共振氢谱中只有2个特征峰的A的同分异构体的结构简式__________________。
(2)写出X的结构简式______________;J中所含的含氧官能团的名称为_________。
(3)E与H反应的化学方程式是_______________;反应类型是______________。
(4)B、C的混合物在NaOH 乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的结构简式是_________________。
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式________。
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种;④能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2S、②金刚石、③NH4Cl、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是____________,熔化时需要破坏共价键的是____________,熔点最高的是____________,熔点最低的是_____________(填序号)。
(2)属于离子化合物的是_______________________,只有离子键的物质是____________,以分子间作用力结合的物质是____________________(均填序号),③的电子式____________________。
(3)用电子式表示①的形成过程是______________________,用电子式表示⑥的形成过程是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是
A. NaOH和CO2 B. Fe粉在Cl2中燃烧
C. Na和O2 D. NaOH容液和AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是

A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C5H11Cl有8种同分异构体,可推知分子组成为C5H12O的醇类的同分异构体的数目是( )
A. 8种 B. 7种 C. 6种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
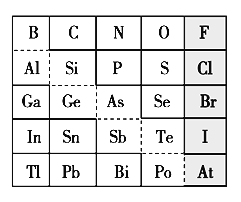
(1)元素Ga在元素周期表中的位置为:______________。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水中后有1.16g白色沉淀,在所得的悬独液中逐滴加入1mol·L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示。试回答:

(1)A点沉淀物的化学式为_____________,
(2)AlCl3的物质的量为________________。
(3)HCl溶液在Q点的加入量是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
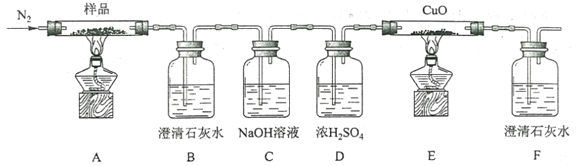
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com