
���� ��1���������������·�Ӧ���������ƣ�
��2����˿��������ȼ�������Ȼ�����
��3�����������������̼��Ӧ����̼���ƺ�������
��4��Ư��[Ca��ClO��2]������ԭ������H2O��CO2��������̼��ơ�HClO��
��5�����������ֽ�����HCl��������
��6��̼��������Һ������������Һ��ϣ���Ӧ����̼���ƺ�ˮ��
��7��ʵ���Ҷ���������β������������NaOH�������ķ�Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��8����������ˮ����Ӧ����HCl��HClO��HClOʹ��ɫ������ɫ��
��9������NaHCO3����Ba��OH��2��Һ�У���Ӧ����̼�ᱵ��ˮ��NaOH��
��10��FeBr2��Һ��ͨ�����Cl2��Ӧ�����Ȼ������壮
��� �⣺��1���������������·�Ӧ���������ƣ���ѧ��ӦΪ4Na+O2�T2Na2O���ʴ�Ϊ��4Na+O2�T2Na2O��
��2����˿��������ȼ�������Ȼ�������ѧ��ӦΪ2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3���ʴ�Ϊ��2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3��
��3�����������������̼��Ӧ����̼���ƺ���������ѧ��ӦΪ2Na2O2+2CO2=2Na2CO3+O2���ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��
��4��Ư��[Ca��ClO��2]������ԭ������H2O��CO2��������̼��ơ�HClO����ѧ��ӦΪCa��ClO��2+CO2+H2O=CaCO3��+2HClO���ʴ�Ϊ��Ca��ClO��2+CO2+H2O=CaCO3��+2HClO��
��5�����������ֽ�����HCl����������ѧ��ӦΪ2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2�����ʴ�Ϊ��2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2����
��6��̼��������Һ������������Һ��ϣ���Ӧ����̼���ƺ�ˮ����ѧ��ӦΪNaHCO3+NaOH�TNa2CO3+H2O���ʴ�Ϊ��NaHCO3+NaOH�TNa2CO3+H2O��
��7��ʵ���Ҷ���������β������������NaOH�������ķ�Ӧ�����Ȼ��ơ��������ƺ�ˮ�����ӷ�ӦΪCl2+2OH-�TCl-+ClO-+H2O���ʴ�Ϊ��Cl2+2OH-�TCl-+ClO-+H2O��
��8����������ˮ����Ӧ����HCl��HClO��HClOʹ��ɫ������ɫ�����ӷ�ӦΪCl2+H2O=H++Cl-+HClO���ʴ�Ϊ��Cl2+H2O=H++Cl-+HClO��
��9������NaHCO3����Ba��OH��2��Һ�У���Ӧ����̼�ᱵ��ˮ��NaOH�����ӷ�ӦΪBa2++OH-+HCO3-�TBaCO3��+H2O���ʴ�Ϊ��Ba2++OH-+HCO3-�TBaCO3��+H2O��
��10��FeBr2��Һ��ͨ�����Cl2��Ӧ�����Ȼ������壬���ӷ�ӦΪ2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl-���ʴ�Ϊ��2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl-��
���� ���⿼�黯ѧ����ʽ�����ӷ���ʽ����д��Ϊ��Ƶ���㣬�������ʵ����ʡ������ķ�Ӧ�����ӷ�Ӧ����д����Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ����ѧ�����Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һάSiC���װ����ȱ��������С�����н�ǿ���������� | |
| B�� | ������Ӧ��SiC���������������ǻ�ԭ���� | |
| C�� | SiCl4���ɼ��Լ����ɵķǼ��Է��� | |
| D�� | ÿ����1mol SiCת��8mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����ʵ | ���۽��� |
| A | H2S�ķе��H2O�ĸ� | H2S�ķ��»�������H2O�ķ��»��� |
| B | ��һ������Mg��Al | Mg��3P�������ȫ��״̬�������ͣ�Խ�ȶ� |
| C | �۵�Na��Al | ͬΪ�������壬Alԭ�Ӱ뾶С����Χ���Ӷ࣬�����ܴ� |
| D | ���ļ��ԣ�H-O��N-H | �ǽ����Բ���Խ���ļ���ԽС |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��A��=1.0mol/L c��B��=0.2mol/L | B�� | c��B��=0.5mol/L c��C��=1.2mol/L | ||
| C�� | c��A��=0.4mol/L c��C��=1.8mol/L | D�� | c��A��=0.9mol/L c��B��=0.5mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
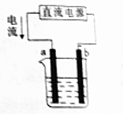
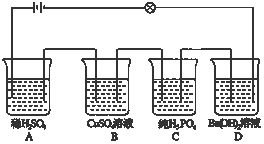
| A�� | a���� | |
| B�� | ��b�����ĵ�Դһ��������ԭ��Ӧ | |
| C�� | �ø�װ�������϶�ͭʱ��bΪ���� | |
| D�� | �ø�װ�õ�⾫��ͭ����a��Ϊ��ͭ���������ҺΪCuSO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �ۢ� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
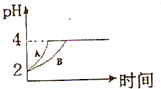 ����������Ũ�Ⱦ�Ϊ1��10-3mol/L�ļ�����Һ�������ᡢ�ڴ��ᡢ�۰�ˮ����NaOH��Һ���ش��������⣺
����������Ũ�Ⱦ�Ϊ1��10-3mol/L�ļ�����Һ�������ᡢ�ڴ��ᡢ�۰�ˮ����NaOH��Һ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܢ٢ڢ� | B�� | �ܢۢ٢� | C�� | �ܢ٢ۢ� | D�� | �ۢڢ٢� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com