
| A. | 从有机物分类看,它可属于氨基酸类、酯类、芳香类 | |
| B. | 它能与盐酸反应,但不能与苛性钠溶液反应 | |
| C. | 甲酸丁酯基(-COOC4H9)有三种同分异构体 | |
| D. | 它的分子式为C11H15NO2 |
分析 根据所给有机物的名称判断出其结构特点:分子中有一个苯基,苯基的对位上有一个氨基、一个甲酸丁酯基,应为: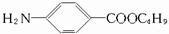 ,然后根据对氨基苯甲酸丁酯含有的官能团进行解答.
,然后根据对氨基苯甲酸丁酯含有的官能团进行解答.
解答 解:A.由于有机物中无羧基,故不属于氨基酸,故A错误;
B.结构中含有氨基、酯基,应能与盐酸、NaOH反应,故B错误;
C.作为丁基有四种排列方式,只要结构中含有丁基,至少应有四种同分异构体,故C错误.
D.由结构简式可知分子中含有11个C,15个H,2个O,1个N,则分子式为C11H15NO2,故D正确;
故选D.
点评 本题考查有机物的结构和性质,为高频考点,解答本题的关键是能根据有机物的名称正确写出结构简式,注意选项D中丁基的同分异构体数目,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
. )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).

 $→_{H_{2},△}^{催化剂}$
$→_{H_{2},△}^{催化剂}$ $→_{Br_{2}}^{光照}$
$→_{Br_{2}}^{光照}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 16.8g | C. | 19.6g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 全部由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 只有在双原子单质分子中,相同的非金属原子之间才能形成化学键 | |
| D. | 两个非金属原子间可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com