
分析 A.CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O该反应为置换反应,属于氧化还原反应;
B.2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑该反应为分解反应,Cl、O元素的化合价发生变化;
C.Cl2+2NaOH═NaCl+NaClO+H2O 反应中Cl元素的化合价发生变化;
D.2FeBr2+3Cl2═2FeCl3+2Br2 反应中Fe、Br、Cl元素的化合价发生变化;
E.H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 该反应为分解反应,O元素的化合价发生变化;
F.KClO3+6HCl═KCl+3Cl2↑+3H2O反应中Cl元素的化合价发生变化.
解答 解:A.CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O该反应为置换反应,属于氧化还原反应;
B.2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑该反应为分解反应,Cl、O元素的化合价发生变化,属于氧化还原反应;
C.Cl2+2NaOH═NaCl+NaClO+H2O 反应中Cl元素的化合价发生变化,属于氧化还原反应;
D.2FeBr2+3Cl2═2FeCl3+2Br2 反应中Fe、Br、Cl元素的化合价发生变化,属于氧化还原反应;
E.H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 该反应为分解反应,O元素的化合价发生变化,属于氧化还原反应;
F.KClO3+6HCl═KCl+3Cl2↑+3H2O反应中Cl元素的化合价发生变化,属于氧化还原反应;
(1)既是分解反应,又是氧化还原反应的是BE;故答案为:BE;
(2)同一种物质中,同种元素间发生氧化还原反应CE;故答案为:CE;
(3)不同物质的同种元素间发生氧化还原反应F;故答案为:F;
(4)所有元素均参加氧化还原反应的是D;故答案为:D.
点评 本题主要考查了氧化还原反应的判断、化学反应的基本类型与氧化还原反应的关系,题目难度不大,注意根据元素的化合价的变化来判断氧化还原反应.


科目:高中化学 来源: 题型:选择题
| A. | 推广燃煤脱硫技术,减少SO2污染,同时把煤粉碎了再燃烧以提高煤的燃烧效率 | |
| B. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| C. | 推广煤的气化、液化技术,提供清洁燃料和化工原料 | |
| D. | 在汽车尾气处理器中使用新的催化剂,促使平衡2CO+2NO?2CO2+N2向正反应方向移动,减少污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
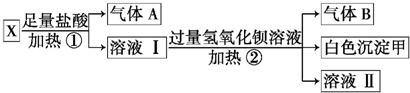
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 实验室制氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| C. | 稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| D. | 氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
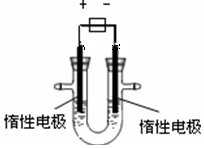
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
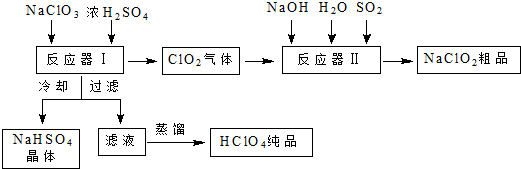
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
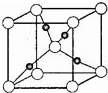 甲烷在一定条件下可生成以下微粒:
甲烷在一定条件下可生成以下微粒:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com