
| A. | 3 mol/(L•s) | B. | 2mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 0.5mol/(L•s) |
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr两原子的核外电子总数相等 | |
| B. | ${\;}_{40}^{95}$Zr的中子数和电子数之差为55 | |
| C. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr是同种核素 | |
| D. | ${\;}_{40}^{95}$Zr属于非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序为M>W>X>Z>Y | |
| B. | W元素形成的可溶性盐溶液一定显碱性 | |
| C. | M、X只能形成离子化合物,且形成的离子化合物中只含离子键 | |
| D. | W的氧化物与Z、M的最高价氧化物的水化物均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲:测定一定时间内生成H2的速率 | |
| B. | 装置乙:萃取碘水中的碘 | |
| C. | 装置丙:海水蒸馏得淡水 | |
| D. | 装置丁:测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
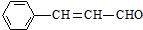 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A. | 1 mol该有机物发生银镜反应能生成 1 mol Ag | |
| B. | 1 mol该有机物最多能够与4 mol H2 发生加成反应 | |
| C. | 它与 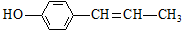 互为同分异构体 互为同分异构体 | |
| D. | 该有机物能使高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com