
| A. | 配置硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | |
| B. | 用托盘天平称量8.75g NaCl固体 | |
| C. | 将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | |
| D. | 分液时,将上层液体从分液漏斗上口倒出,下层液体从分液漏斗下口放出 |
分析 A.容量瓶只能配制溶液,不能溶解或稀释药品;
B.托盘天平的感量是0.1g;
C.蒸馏时,温度计测量馏分温度;
D.分液时,分液漏斗中上层液体从上口倒出,下层液体从下口倒出.
解答 解:A.容量瓶只能配制溶液,不能溶解或稀释药品,容量瓶不能用来稀释溶液,应先在小烧杯中稀释,冷却至室温后,再转移到容量瓶中,故A错误;
B.托盘天平的感量是0.1g,所以托盘天平不能称量出8.75g氯化钠固体,故B错误;
C.蒸馏时,温度计测量馏分温度,所以温度计水银球位于蒸馏烧瓶支管口处,故C错误;
D.分液时,分液漏斗中上层液体从上口倒出,为防止引进杂质,下层液体从下口倒出,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液配制、固体称量、物质分离提纯等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
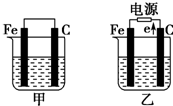 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下测得1 mol N2 的质量为 28 g | |
| B. | 用量筒测得排水法收集制得的氢气体积为 50.28 mL | |
| C. | 用两只250 mL的容量瓶配置0.1 mol/L 500 mL 的 NaOH 溶液 | |
| D. | 用托盘天平称得 2.50 g 胆矾,受热充分失水后,固体质量减轻 0.90 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③⑤ | C. | 全部 | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 相 关 实 验 |  | 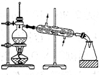 |  |  |
| 目的 | 探究接触面积对反应速率的影响 | 分离沸点相差较大的 互溶液体混合物 | 探究温度对化学 平衡的影响 | 探究不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D的结构式:H-O-H.
;D的结构式:H-O-H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com