
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
分析 (1)配制溶液的实验步骤为:计算、量取、稀释、移液、洗涤移液、定容、摇匀等,据此进行分析;
(2)根据烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的减少,应将洗涤液全部转移到容量瓶中;根据热溶液体积偏大,影响溶液的浓度;
(3)根据c=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;
(4)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(硫酸),接着根据关系式:H2SO4~2NaOH来计算;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)配制溶液250mL,配制步骤有量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以操作顺序为②③①⑥⑤④,
故答案为:②③①⑥⑤④;
(2)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的减少,应将洗涤液全部转移到容量瓶中;因热溶液体积偏大,冷却下来时溶液体积变小,则浓度会变大,所以高温会使得容量瓶的体积不准确,
故答案为:使硫酸转移完全;高温会使得容量瓶的体积不准确;
(3)进行⑤的实验操作时若加蒸馏水时不慎超过了刻度,溶液的体积偏大,根据c=$\frac{n}{V}$可知浓度偏小,
故答案为:偏小;
(4)三次滴定消耗硫酸的体积为:18.50mL,22.45mL,18.48mL,第2组数据与前两次的实验结果相差太大,舍去第2组数据,然后求出1、3组平均消耗V(硫酸)=$\frac{18.50+18.48}{2}$mL=18.49mL,由关系式:H2SO4~2NaOH,可知NaOH的物质的量浓度为c(NaOH)=$\frac{0.100mol/L×18.49mL×2}{20mL}$=0.185mol/L,
故答案为:前两次的实验结果相差太大;0.185;
(5)a.滴定管在盛放酸或者碱溶液时必须润洗,否则会将待装液稀释,如:酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,导致标准液浓度减小,滴定时消耗的标准液体积偏大,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,测得的NaOH溶液的浓度将偏大,故a错误;
b.取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏小,故b正确;
c.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2-3次,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏大,故c错误;
d.滴定前在锥形瓶中有少量蒸馏水,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)不变,故d错误;
故答案为::b.
点评 本题主要考查酸碱中和滴定,涉及了滴定过程,误差分析,浓度求算等知识,侧重分析与实验能力的考查,注意误差分析中操作不当操作对酸、碱的量的影响,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色,透明,稳定的液体都是溶液 | |
| B. | 悬浊液和乳浊液不稳定,可以放置一段时间后分别用过滤和分液的方法分离. | |
| C. | 胶体区别于其它分散系的本质特征是丁达尔现象 | |
| D. | 电泳现象是胶体特有的一种性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

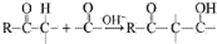
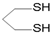 用系统命名法命名,它的名称是1,3-丙二硫醇;
用系统命名法命名,它的名称是1,3-丙二硫醇;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
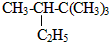 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷;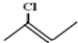 表示的分子式为C4H7Cl.
表示的分子式为C4H7Cl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
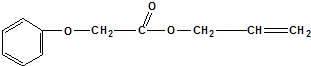 是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸
是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸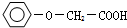 发生酯化反应的产物.
发生酯化反应的产物.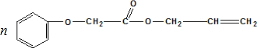 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$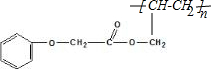 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.装置如图所示,根据上述情况,回答下列问题:
现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.装置如图所示,根据上述情况,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com