
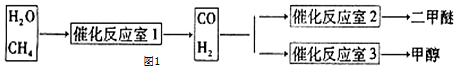

分析 (1)已知:①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455kJ/mol,②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol,$\frac{①+②}{3}$可得CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程;
(2)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)为放热反应,提高CO的转化率,应使平衡正向移动;
(3)增大压强,平衡向体积缩小的方向移动,温度升高,平衡向着吸热方向进行.在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,结合图象判断甲醇的物质的量分数变化情况判断;
(4)平衡常数等于生成物与反应物的浓度幂比值,正反应物为吸热反应,降低温度,平衡逆向移动;
(5)二甲醚被氧化,为原电池的负极,碱性条件下生成碳酸根离子和水.
解答 解:(1)已知:①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455kJ/mol,②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol,$\frac{①+②}{3}$可得CO(g)+H2(g)+O2(g)?CO2(g)+H2O(l)△H=$\frac{-1455kJ/mol-247kJ/mol}{3}$=-567.3kJ/mol,
故答案为:CO(g)+H2(g)+O2(g)?CO2(g)+H2O(l)△H=-567.3kJ/mol;
(2)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)为放热反应,提高CO的转化率,应使平衡正向移动,可降低温度,增大压强,或分离出二甲醚,
故答案为:AD;
(3)增大压强,平衡向体积缩小的方向移动,在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,
温度升高,平衡向着吸热方向进行,在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,故T1>T2>T3>T4,
故答案为:CD;
(4)对于CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$,正反应物为吸热反应,降低温度,平衡逆向移动,则平衡常数减小,
故答案为:k=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$;变小;
(5)二甲醚被氧化,为原电池的负极,碱性条件下生成碳酸根离子和水,电极方程式为CH3OCH3-12e-+16OH-=2CO32-+11 H2O,
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
点评 本题考查化学平衡的影响因素以及化学平衡的计算知识,为高频考点,侧重考查学生的分析能力和计算能力的考查,属于综合知识的考查,注意根据平衡移动原理分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NCl2 | B. | NCl3 | C. | NCl4 | D. | NCl5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国起征燃油税,这是政府推进节能减排的一项新举措.石油工业通过石油分馏得到汽油,主要发生了化学变化 | |
| B. | 2008年诺贝尔化学奖授予研究绿色荧光蛋白的科学家,利用丁达尔效应不能将蛋白质溶液和葡萄糖溶液区分开 | |
| C. | 广为人知的奶粉事件中的罪魁祸首为三聚氰胺(结构如 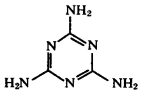 图),其摩尔质量为126g•mol-1 图),其摩尔质量为126g•mol-1 | |
| D. | 2010年4月支援青海玉树地震灾区的生活用品中的食醋、纯碱、食盐,其对应的主要化学物质分别属于酸、碱、盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
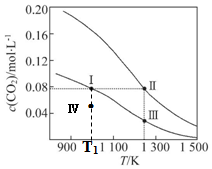
| A. | 该反应的△H>0、△S<0 | B. | 体系的总压强p:p (Ⅰ)>p (Ⅲ) | ||
| C. | 平衡常数:K(Ⅰ)>K (Ⅱ) | D. | T1K时,Ⅳ点所处的状态中 v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 刚充入时反应速率υ正减少,υ逆增大 | |
| B. | 平衡向正反应方向移动 | |
| C. | 平衡向逆反应方向移动 | |
| D. | 物质C的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
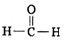 )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA| A. | ①④ | B. | ③④ | C. | ②⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
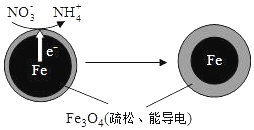 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 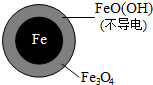 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的电子式: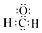 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: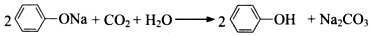 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入肥皂液产生浑浊的水是硬水 | |
| B. | 软水不一定是纯水 | |
| C. | 硬水中的钙、镁离子通过加热煮沸可以完全沉下 | |
| D. | 硬水加入石灰一纯碱后生成Mg(OH)2和CaCO3沉淀;利用离子交换剂也可把硬水软化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com