
分析 发生Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,气体的物质的量与Zn的物质的量相等,结合反应及守恒法计算.
解答 解:(1)n(H2SO4)=0.1L×18.5mol/L=1.85mol,反应后的溶液稀释至1L后测得溶液中氢离子的浓度为0.1mol/L,可知此时溶液中尚余0.1mol H+,可知参加反应的硫酸为1.85mol-0.05mol=1.8mol,开始生成二氧化硫,后Zn与稀硫酸反应生成氢气,
设生成的H2和SO2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=1.8}\end{array}\right.$
解得x=0.3mol,y=1.2mol,
则生成的H2和SO2的物质的量之比为0.3mol:1.2mol=1:4,
物质的量比等于体积比,则A中H2和SO2的体积之比为1:4,
答:A中H2和SO2的体积之比为1:4;
(2)n(气体)=$\frac{33.6L}{22.4L/mol}$=1.5mol,由Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,可知气体的物质的量与Zn的物质的量相等,则参加反应的Zn为1.5mol×65g/mol=97.5g,
答:反应中所消耗的锌有97.5g.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
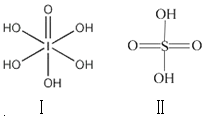 已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).
已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
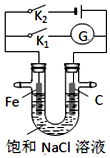
| A. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| B. | K1闭合,铁棒上发生的反应为2H++2e→H2↑ | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
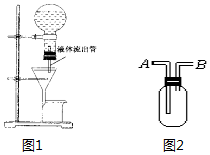 (1)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图1所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通.
(1)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图1所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
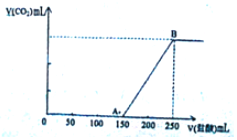 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨基酸既显酸性又显碱性 | |
| B. | 可用碘水检验淀粉是否水解完全 | |
| C. | 变质的油脂有难闻的气味,是由于油脂发生了水解反应 | |
| D. | 纤维素水解和淀粉水解得到的最终产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示图象中.纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按试题将相应图的字母填入下列空格.
如图所示图象中.纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按试题将相应图的字母填入下列空格.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com