
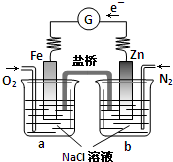
| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |


科目:高中化学 来源: 题型:
| A、Ca(OH)2+2CH3COOH=(CH3COO)2Ca+2H2O |
| B、HCl+NH3?H2O=NH4Cl+H2O |
| C、2HNO3+Ba(OH)2=Ba(NO3)2+2H2O |
| D、Mg(OH)2+H2SO4=MgSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
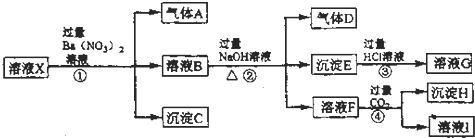
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量四氯化碳, | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com