
| A. | 当△H为负值时,表示该反应为吸热反应 | |
| B. | 反应热的大小只与反应体系的始态和终态有关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物具有的能量无关 | |
| D. | 热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,表示2 L氢气和1 L氧气反应放出571.6 kJ的热量 |
分析 A.放热反应的焓变为负极,吸热反应的焓变为正值;
B.化学反应的能量变化与中间途径无关,与反应物、生成物的始态和终态有关;
C.反应热大小取决于反应物、生成物总能量之差;
D.水的状态影响反应热,该说法中没有指出生成水的状态.
解答 解:A.当△H为负值时,表示该反应为放热反应,故A错误;
B.结合盖斯定律可知,反应热的大小只与反应体系的始态和终态有关,故B正确;
C.反应热的大小取决于反应物所具有的能量和生成物具有的能量,反应物、生成物总能量的差值越大,反应热数值越大,故C错误;
D.热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,表示2L氢气和1L氧气反应生成2mol液态时放出571.6 kJ的热量,故D错误;
故选B.
点评 本题考查了化学反应与能量变化的关系,题目难度中等,明确反应热与焓变的关系为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:实验题
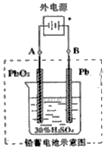 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com