
【题目】一氯甲烷与苯的反应如图所示(无机小分子产物略去)。下列说法正确的是
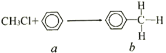
A.该反应属于化合反应
B.a与溴水在铁作催化剂条件下反应生成溴苯
C.b中最多有14个原子共平面
D.b的二氯代物有10种结构
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一绝热的恒容容器中,发生反应:X(s)+2Y(g)![]() M(g)+N(g),下列不能证明反应已达到平衡状态的是(注:绝热指不与外界发生热交换)
M(g)+N(g),下列不能证明反应已达到平衡状态的是(注:绝热指不与外界发生热交换)
A.某一时刻v(Y)=2v(M)B.混合气体的密度不变
C.容器内温度不变D.混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >H2CO3>
>H2CO3>![]() ,将
,将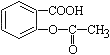 转变为
转变为![]() 的方法是 ( )
的方法是 ( )
A. 与足量的NaOH溶液共热,再通入SO2
B. 与稀H2SO4共热后,加入足量的NaOH溶液
C. 加热溶液,通入足量的CO2
D. 与稀H2SO4共热后,加入足量的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂可有效杀灭新冠病毒(2019-nCoV)。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。装置见下图。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3混合通入含水8%的碳酸钠中制Cl2O,并用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
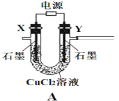
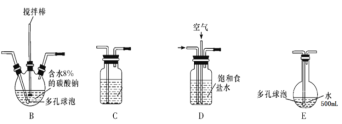
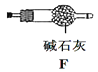
(1)电极Y应该连接电源的___(填“正极”或“负极”),装置C内应盛放_________,各装置的连接顺序为A—________________________________
(2)反应过程中,装置B需放在冷水中,其目的是_____________________________。已知装置B产物含有一种酸式盐,则发生反应的化学方程式为___________________。
(3)实验中控制氯气与空气体积比的方法是_______________________________
(4)装置E中使用棕色平底烧瓶的原因是(用化学方程式表示)________________
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
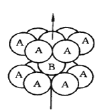
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)基态钛原子的价层电子排布图为__________,其原子核外共有______种空间运动状态不同的电子,金属钛的堆积方式如图所示,为________(填堆积方式)堆积
(2)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,均高于结构与其相似的CCl4,主要原因是_______。
②TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有______。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.金属键
(3)硫酸氧钛晶体中阳离子为链状聚合形式,结构如图所示,其中Ti-O-Ti在一条直线上。该阳离子化学式为__________,其中O原子的杂化方式为_______。
![]()
(4)2016年7月,研究人员发现了某种钛金合金的化学式是Ti3Au,它具有生物相容性,是理想的人工髋关节和膝关节;其晶胞结构如图所示,晶胞参数为a pm,最近的Ti原子距离为![]() ,A原子的坐标参数为(
,A原子的坐标参数为(![]() ,
,![]() ,
,![]() ),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm
),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol 1
Cl2(g) ΔH1=83 kJ·mol 1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2= 20 kJ·mol 1
Cl2(g) ΔH2= 20 kJ·mol 1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3= 121 kJ·mol 1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol 1。其中O2的电子式为__________
(2)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和H2 ,放出225KJ热量,该反应的热化学方程式为________________________。SiHCl3中含有的化学键类型为__________
(3)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3
则反应③的ΔH3______(用ΔH1,ΔH2表示)。
(4)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式________________________
(5)氯化铵常用作焊接.如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:_______CuO+______NH4Cl![]() ______Cu+______CuCl2+______N2↑+______H2O
______Cu+______CuCl2+______N2↑+______H2O
①配平此氧化还原反应方程式___________________________
②此反应中若产生0.2mol的气体,则有__________mol的电子转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 0.5mol雄黄(As4S4),结构如右图,含有NA个S-S键![]()
B. 将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C. 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D. 高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B. CH2===CH2+HCl―→CH3CH2Cl
C. CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
D. 2CH3CH3+7O2![]() 4CO2+6H2O
4CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
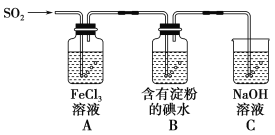
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com