
| A、水是一种极弱的电解质,存在电离平衡H2O?H++OH-.在水中加入少量MgSO4固体时,上述平衡将向正反应方向移动,KW增大 |
| B、在MgSO4溶液中各离子浓度关系:c(Mg2+)+c(OH-)=c(OH-)+c(SO42-) |
| C、向1L0.01 mol.L-1MgSO4溶液中加入1L 0.001 mol.L-1CaCl2溶液即可生成CaSO4沉淀 |
| D、若溶液中某离子的浓度低于1.0×10-5mol.L-1即可认为该离子被除尽,常温下要出去0.1 mol.L-1MgSO4溶液中的Mg2+,至少要调节pH≥11. |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④ |
| C、①②③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3和NaHCO3的中性混合溶液中:c(Na+)=c(HSO3-)+2c(SO32-)+c(HCO3-)+2c(CO32-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<②<③ |
| D、等体积物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种溶液pH的大小顺序:①>④>③>② |
| B、溶液①、②等体积混合后pH>7,则c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D、向溶液③、④中分别加入25mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
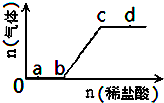 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、SO42-、NO3-、Fe(OH)3胶体微粒 |
| B、b点对应的溶液中:Al3+、H+、MnO4-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅单质可用于光纤通讯 |
| B、由SiO2制取硅酸,可先使SiO2与NaOH溶液反应,再通入CO2 |
| C、青石棉[Na2Fe5Si8O22(OH)2]的化学组成可表示为:Na2O?3FeO?Fe2O3?8SiO2?H2O |
| D、Na2SiO3可用于制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池的能量转换形式之一为化学能转化为电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D、催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com