
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
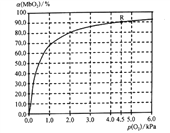
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
【答案】 (d-a-b-c) kJ mol-1 7.4 减小 当少量酸性物质进入血液后,平衡H2CO3![]() H++HCO3-向左移动,使H+浓度变化较小,血液的pH基本不变 < 2.00kPa-1 120s-1·kPa-1
H++HCO3-向左移动,使H+浓度变化较小,血液的pH基本不变 < 2.00kPa-1 120s-1·kPa-1
【解析】试题分析:本题通过对“人体血液中存在平衡”和“肌细胞石储存氧气和分配氧气时存在的平衡”的讨论,主要考查盖斯定律的运用、平衡常数表达式、平衡移动原理等知识,考查考生对平衡移动原理的综合运用能力、综合运用平衡常数的计算能力。
解析:(1)将已知的反应依次编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,将四个反应用Ⅳ-Ⅰ-Ⅱ-Ⅲ既得反应H2CO3 (aq)![]() H+(aq)+HCO3-(aq) ,所以 △H=△H4-△H1-△H2-△H3=(d-a-b-c)kJ mol-1。正确答案:(d-a-b-c)kJ mol-1。(2)
H+(aq)+HCO3-(aq) ,所以 △H=△H4-△H1-△H2-△H3=(d-a-b-c)kJ mol-1。正确答案:(d-a-b-c)kJ mol-1。(2)![]() ,所以
,所以![]() ,
,![]() 。pH升高时,c(H+)减小,所以
。pH升高时,c(H+)减小,所以![]() 随c(H+)减小而减小。正确答案:7.4、减小。(3)由于人体血液中存在平衡:H2CO3 (aq)
随c(H+)减小而减小。正确答案:7.4、减小。(3)由于人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) ,所以少量酸性物质进入血液后,平衡逆向移动,因此H+浓度变化部分被抵消,血液的pH变化较小。正确答案:当少量酸性物质进入血液后,平衡H2CO3
H+(aq)+HCO3-(aq) ,所以少量酸性物质进入血液后,平衡逆向移动,因此H+浓度变化部分被抵消,血液的pH变化较小。正确答案:当少量酸性物质进入血液后,平衡H2CO3![]() H++HCO3-向左移动,使H+浓度变化较小,血液的pH基本不变。(4)Mb(aq)+O2(g)
H++HCO3-向左移动,使H+浓度变化较小,血液的pH基本不变。(4)Mb(aq)+O2(g)![]() MbO2(aq),温度升高时氧气的结合度降低,既升高温度平衡逆向移动,所以正反应为放热反应,△H<0。正确答案:<。(5)“氧气的结合度α(MbO2) 是指氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数”,既
MbO2(aq),温度升高时氧气的结合度降低,既升高温度平衡逆向移动,所以正反应为放热反应,△H<0。正确答案:<。(5)“氧气的结合度α(MbO2) 是指氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数”,既![]() ,则
,则![]() (算式Ⅰ)。①
(算式Ⅰ)。①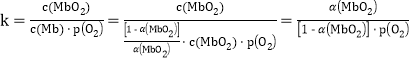 ,代入R点读数
,代入R点读数![]() 。②仍然选R点坐标数据,37 ℃反应达到平衡时,v(正)=v(逆),则k1c(Mb)×P(O2)=k2c(MbO2),代入上述算式Ⅰ及R点坐标数据,所以
。②仍然选R点坐标数据,37 ℃反应达到平衡时,v(正)=v(逆),则k1c(Mb)×P(O2)=k2c(MbO2),代入上述算式Ⅰ及R点坐标数据,所以![]() 。正确答案:2.00kPa-1、120s-1·kPa-1。
。正确答案:2.00kPa-1、120s-1·kPa-1。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘有如下步骤:①通入足量的Cl2,②将海带焙烧成灰后加水搅拌,③加CCl4振荡,④用分液漏斗分液,⑤过滤。合理的操作顺序是( )
A.①②③④⑤B.②⑤①③④C.①③⑤②④D.②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:

(1)操作①中必须用到的一种仪器是______(填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是_________。
(3)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是______(填序号)。
A.粗盐没有全部溶解即过滤 B.蒸发时液滴飞溅剧烈
C.蒸发后所得“精盐”很潮湿 D.蒸发皿上粘有的“精盐”没有全部转移到称量纸上
(4)小明查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中操作⑤得到的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种)。

①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液。从提供的试剂中选出a所代表的试剂是___________、___________。
②在滤液中加盐酸的作用是_____________、____________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用能量判断下列过程的方向的是
A、水总是自发地由高处往低处流
B、有序排列的火柴散落时成为无序排列
C、放热反应容易进行,吸热反应不能自发进行
D、多次洗牌以后,扑克牌的毫无规律的混乱排列的几大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂——甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍清。 请完成下列各题:
请完成下列各题:
(1)四座工厂排出的废液里含有的污染物是:
甲__________乙__________丙___________丁_____________。(填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如下图所示(部分反应条件已略去):
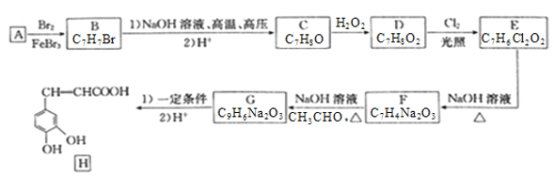
己知:①有机物B苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③![]() ;
;
④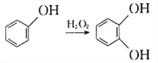 。
。
(1)有机物B的名称为___________________。
(2)由D生成E的反应类型为__________________,E中官能团的名称为__________________。
(3)由G生成H所需的“一定条件”为____________________。
(4)写出B与NaOH溶液在高温高压下反应的化学方程式:___________________________。
(5)F酸化后可得K,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:___________________。
(6)设计由![]() 和丙醛合成
和丙醛合成![]() 的流程图:_______________________ (其他试剂任选)。
的流程图:_______________________ (其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。下列关于该装置的说法错误的是
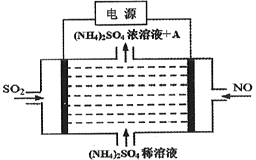
A. SO2通入阳极,该电极上发生氧化反应
B. 物质A为硫酸
C. 阴极的电极反应为: NO-5e-+6H+=NH4++H2O
D. (NH4)2SO4可作为肥料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com