
同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
A.16O和18O是同一种核素 B. 1H218O的摩尔质量为20
C.34S和15N核内的中子数相差9 D.2H+核外电子数为0
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应
① H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
② 2H2S(g)+SO2(g)=S2 (g)+2H2O(g) △H2
③ H2S(g)+O2(g)=S(g)+H2O(g) △H3
④ 2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=(△H1+△H2-3△H3)B.△H4=(3△H3-△H1-△H2)
C.△H4=(△H1+△H2-3△H3) D.△H4=(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 |
|
|
| ① | ② | ③ | ④ |
|
三 | ⑤ | ⑥ | ⑦ |
|
| ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为_____>_____>____ (填元素符号),判断的实验依据是_______(写出一种)。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
同一主族的两种元素的原子序数之差不可能的是
A.16 B.26 C.36 D.46
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于甲烷分子结构的叙述中,正确的是
A.甲烷分子中C、H原子间为离子键
B.甲烷分子的空间结构是正方体
C.甲烷的结构式为CH4
D.甲烷分子中4个碳氢键完全相同
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。R是由A、D两元素形成的离子化合物,其中A+与D2一离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体内晶体类型应属于 (填写“六方”、“面心立方”或“体心立方”)堆积,空间利用率为 。
(2)C3-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化,CB3分子的VSEPR模型为 。
(3)C的氢化物在水中的溶解度如何 ,为什么具有这样的溶解性 。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:
(用元素符号表示);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是p g·cm-3试计算R晶体中A+和D2-最短的距离 。
(阿伏加德罗常数用NA表示,只写出计算式,不用计算)
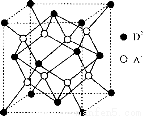
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知谷胱甘肽水解后产生的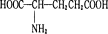 同分异构体有很多,其中含有一个甲基、一个硝基和一个羧基的同分异构体共有 ( )
同分异构体有很多,其中含有一个甲基、一个硝基和一个羧基的同分异构体共有 ( )
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:实验题
(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
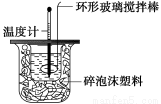
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_________________________
________________________________________________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
|
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=_______________________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、H2PO4-、SO42-、PO43-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④通入CO2的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe2+的溶液中: Na+、NH4+、[Fe(CN)6]3-、CO32-
⑥酸性溶液中:Na+、Al3+、NO3-、I-
A.①②B.③⑥C.②④D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com