
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
解析 (1)燃烧热指的是1 mol燃料完全燃烧生成稳定氧化物时放出的热量,因此根据定义先写出反应的化学方程式:S8(s)+8O2(g)===8SO2(g),又由于题干中给出的焓变是指生成1 mol产物的数据,因此该反应的热化学方程式为S8(s)+8O2(g)===8SO2(g) ΔH=-8a kJ·mol-1。(3)设S8分子中硫硫键的键能为x kJ·mol-1,反应热等于反应物的键能之和减去生成物的键能之和,结合(1)可得8x+8e-16d=-8a,解得x=2d-a-e。
答案 (1)S8(s)+8O2(g)===8SO2(g) ΔH=-8a kJ·mol-1 (2)2SO3(g)===2SO2(g)+O2(g) ΔH=+2b kJ·mol-1 (3)(2d-a-e)kJ·mol-1


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉水解是否完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )。
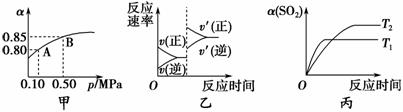
A.由图甲推断,B点SO2的平衡浓度为0.3 moL·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2的平衡转化率与温度关系如图丙,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量二氧化碳,对燃煤废气进行脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。将CO2转化为甲醇是一种新型脱碳技术,其反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH。
(1)取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图Ⅰ所示,则上述CO2转化为甲醇的反应的ΔH________0(填“>”、“<”或“=”)。
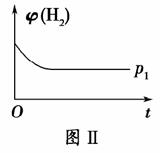

(2)如图Ⅱ是在恒温密闭容器中,压强为p1时H2的体积分数随时间t的变化曲线,请在图中画出该反应在p2(p2>p1)时H2的 体积分数随时间t的变化曲线。
(3)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。

则0~10 min内,氢气的平均反应速率为________;该温度下,反应的平衡常数为________(保留三位有效数字);10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N—N为154,则断裂1 mol N—H 键所需的能量(kJ)是 ( )。

A.194 B.391
C.516 D.685
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学发现在炽热的煤炭上洒少量水,煤炉中会产生淡蓝色的火焰,炉火更旺。因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧时放出更多的热量”。已知:煤炭的燃烧热为 393.15 kJ · mol-1 ,氢气的燃烧热为 242 kJ· mol-1 ,一氧化碳的燃烧热为 283 kJ · mol-1 。下列有关说法正确的是
A.表示氢气燃烧热的热化学方程式为 2H2(g)+ O2(g)===2H2O (l) ΔH= -242 kJ · mol-1
B.表示CO 燃烧热的热化学方程式为 2CO(g)+ O2(g)===2CO2 (g) ΔH= - 566 kJ · mol-1
C.“炉火更旺”是因为少量的固体煤炭转化为可燃性气体
D.因 242 kJ·mol-1 +283 kJ· mol-1 >393.15 kJ·mol-1 ,故该同学的结论是对的
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应过程中一定伴随着能量变化,某同学通过如下实验进行探究。
Ⅰ.探究化学反应中的能量变化。通过如下实验测出,烧杯中的温度降低。

(1)Ba(OH)2·8H2O跟NH4Cl的反应的化学方程式:
________________________________________________________________。
(2)从反应热的角度分析,该反应属于________(填“吸热”或“放热”)反应;从氧化还原角度分析,该反应属于
________(填“氧化还原”或“非氧化还原”)反应;从基本反应类型上分析,该反应属于________反应。
Ⅱ.测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如图所示)。

(1)图中尚缺少的一种仪器是________。
(2)实验时环形玻璃搅拌棒的运动方向是________。
a.上下运动 b.左右运动
c.顺时针运动 d.逆时针运动
(3)写出反应的热化学方程式为_______________________________________
________________________________________________________________________(中和热为57.3 kJ·mol-1)。
(4)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L -130 mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、生产有着密切关系,下列叙述中正确的是 ( )。
A.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀
B.钢铁发生吸氧腐蚀时,OH-失电子释放出O2,钢铁被腐蚀
C.船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体
D.外加电源的正极连接在海水中的钢铁闸门上,可保护闸门
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com