
向溶液X中持续通入气体Y,会产生“浑浊→澄清”现象的是( )
A.X:漂白粉溶液 Y:二氧化硫
B.X:硝酸钡溶液 Y:二氧化硫
C.X:氯化铝溶液 Y:氨气
D.X:偏铝酸钠溶液 Y:二氧化氮
科目:高中化学 来源: 题型:
实验室用下列方法测定某水样中O2的含量。
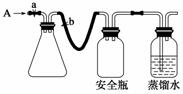
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________。
再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。然后用Na2S2O3标准溶液滴定生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴________作指示剂;
⑧用0.005 mol·L-1 Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________(单位:mg·L-1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关钢铁腐蚀说法正确的是( )
A.钢铁腐蚀时铁作正极
B.钢铁腐蚀时铁发生的反应为:Fe-3e-====Fe3+
C.在碱性环境中正极反应式为:O2+2H2O+4e-====4OH-
D.在酸性环境中正极反应式为:O2+4H++4e-====2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是制备和研究乙炔性质的实验装置图。下列说法不正确的是( )
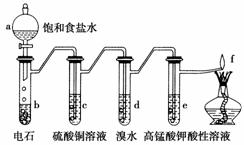
A.制备乙炔的反应原理是CaC2+2H2O―→Ca(OH)2+C2H2↑
B.c的作用是除去影响后续实验的杂质
C.d中的有机产物与AgNO3溶液混合能产生沉淀
D.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:________________________________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
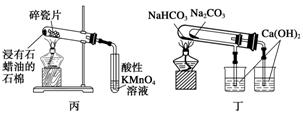
用下列装置不能达到有关实验目的的是( )
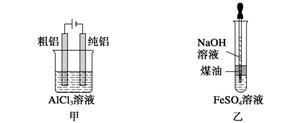
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.丙图装置酸性KMnO4溶液中出现气泡且颜色逐渐褪去
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1 mol CH4(g)和2 mol O2(g)的能量总和小于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
C.1 mol Fe在氧气中充分燃烧失去3NA个电子
D.在标准状况下,NA个CHCl3分子所占的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
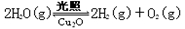 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c |
|
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:
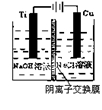
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米 Cu2O,装置
如右图所示:该电池的阳极反应式为 钛极附近的pH值
(增大、减小、不变)
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制 备纳米级Cu2O,
备纳米级Cu2O,
同时放出N2。该制法的化学方程式为 
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:  △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。
| 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050[Co | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.0 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母)。
A.实验的温度:T2<T1 B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com