
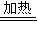 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O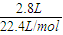 =0.125mol,结合反应的化学方程式计算.
=0.125mol,结合反应的化学方程式计算.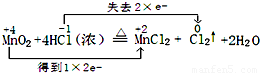 ,
,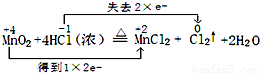 ;
;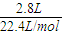 =0.125mol,
=0.125mol, MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O 被氧化HCl
MnCl2+Cl2↑+2H2O 被氧化HCl

科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:河南省卫辉市第一中学2012届高三3月考试化学试题 题型:013
|
下列实验操作能够达到实验目的的是 | |
| [ ] | |
A. |
从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 |
B. |
取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
C. |
用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 |
D. |
在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省卫辉市高三3月考试化学试卷 题型:选择题
下列实验操作能够达到实验目的的是
A.从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体
D.在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com