
【题目】下列有关热化学方程式的表示及说法正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
C.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
D.已知I2(g)+H2(g)=2HI(g)△H1<0;I2(s)+H2(g)=2HI(g )△H2<0,则△H1>△H2
【答案】B
【解析】A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析,选项中水是气体不是液态氧化物,故燃烧热大于241.8kJ/mol,A不符合题意;
B、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量,含20.0g NaOH物质的量为0.5mol的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)═
H2SO4(aq)═ ![]() Na2SO4(aq)+H2O(l)△H=﹣57.4kJ/mol,B符合题意;
Na2SO4(aq)+H2O(l)△H=﹣57.4kJ/mol,B符合题意;
C、能量越低,物质越稳定;能量越高,物质越不稳定,已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定,C不符合题意;
D、碘单质固体变化为气体吸热,焓变为负值进行比较大小,则△H1<△H2,D不符合题意;
所以答案是:B


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 纤维素![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 淀粉![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
D. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备. 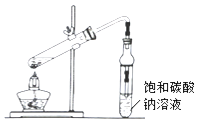
完成下列填空:
(1)铁架台上的试管中发生的反应方程式是 .
(2)饱和Na2CO3溶液的作用是 .
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,、 , 然后分液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,能判断反应X(s)+2Y(g) ![]() M(g)+N(g)达到最大限度的是( )
M(g)+N(g)达到最大限度的是( )
A. 压强不变
B. 生成M与N的物质的量之比为1:1
C. 生成1molM同时消耗2molY
D. 生成M的速率和消耗N的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
A. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
B. 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的1.8倍,则m+n > p+q
C. 若m+n = p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若温度不变缩小容器体积,达到新平衡时压强增大到原来的2倍,则体积一定小于原来的1/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H =-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO3+SO3(快);4VO2+O2→2V2O5(慢)
2SO3(g) △H =-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO3+SO3(快);4VO2+O2→2V2O5(慢)
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 该反应逆反应的活化能大于198kJ/mol D. 升高温度,该反应的△H增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com