
| 0.224L |
| 22.4L/mol |
| 1.86g-0.74g |
| 56g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
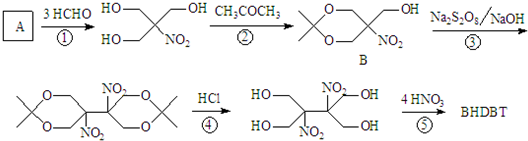
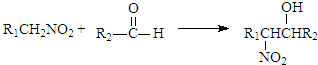 (将R1CH2NO2中硝基换为醛基,也能发生类似反应)
(将R1CH2NO2中硝基换为醛基,也能发生类似反应) ),合成过程中无机试剂任选,合成路线流程图示例如下:CH3CH2OH
),合成过程中无机试剂任选,合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
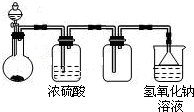
| A、浓氨水与氧化钙固体反应制氨气 |
| B、稀硫酸与硫化亚铁固体反应制硫化氢 |
| C、浓盐酸与次氯酸钙固体反应制氯气 |
| D、饱和食盐水与电石反应制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去NO中混有的NO2:用水洗气 |
| B、Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
| C、加入新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D、向某溶液中先加入硝酸,后再加入BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过量氨水除去Al3+溶液中的少量Fe3+ |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、向某溶液中加HCl酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
| D、向澄清石灰水中通入少量气体产生沉淀,过量时沉淀溶解,说明该气体一定是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率为v(PCl3)=0.0032mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0molPCl5、2.0molCl2,达到平衡时,PCl5的转化率大于20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com