
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
分析 (1)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)①高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管;根据滴定结束前溶液为无色,滴定结束时溶液变成紫红色到达滴定终点;
②先判断滴定数据的有效性,然后计算出消耗标准液的平均体积,再根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算出待测液的浓度;
(3)滴定结束时,继续滴加滴定剂,滴定剂和指示剂反应生成有明显颜色变化的沉淀,保证滴定剂和被滴定物完全反应.
解答 解:(1)A.滴定终点读数时,俯视滴定管刻度,其他操作正确,导致V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏低,故A错误;
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,此操作正确,不影响测定结果,故B错误;
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,导致标准液浓度减小,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏高,故C正确;
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏高,故D正确;
故选CD;
(2)①高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,所以应该使用酸式滴定管盛装高锰酸钾溶液;
滴定结束前混合液为无色,滴定结束时混合液变成了紫红色,所以滴定终点现象为:锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色,
故答案为:酸;锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色;
②三次滴定消耗标准液体积分别为:19.90mL,20.00mL,20.10mL,三次滴定的数据都有效,消耗标准液的平均体积为:$\frac{19.90mL+20.00mL+20.10mL}{2}$=20.00mL,高锰酸钾的物质的量为0.1mol•L-1×0.020L=0.002mol,根据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,n(H2C2O4)=$\frac{5}{2}$n(KMnO4)=0.005mol,待测液草酸的物质的量浓度c(H2C2O4)=$\frac{0.005mol}{0.025L}$=0.2 mol•L-1;
故答案为:0.2 mol•L-1;
(3)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,
故答案为:D.
点评 本题考查了中和滴定操作,涉及中和滴定、氧化还原滴定、沉淀滴定,掌握反应原理是解题的关键,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
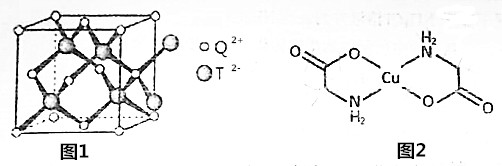
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 30 | / |
| Ⅲ | 1mL | 20 | 1mL蒸馏水 |
| Ⅳ | A | 20 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
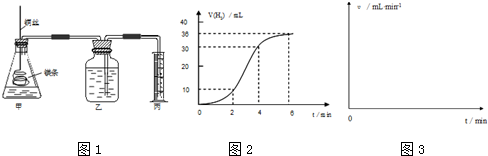
 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 22.32 | 24.39 | 24.41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量二氧化碳通入“水玻璃”中:C02+SiO32-+H20═C032-+H2SiO3↓ | |
| B. | 氨水滴入 AlCl3 溶液中:Al3++30H-═Al(0H)3↓ | |
| C. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | Al2O3溶于 NaOH 溶液中:Al2O3+2OH-+3H2O=2[Al(0H)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质也一定是Y2 | |
| D. | 若Y的最高正化合价为+m,则X的最高正化合价一定为+m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
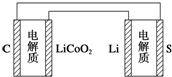 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com