
| A. | 石油裂解可获得乙烯,可从煤干馏得到的煤焦油中提取苯 | |
| B. | 衣服中的棉、麻成分都属于纤维素 | |
| C. | 用纯碱制玻璃,用铁矿石炼铁都会产生温室气体CO2 | |
| D. | 地沟油和矿物油的主要化学成分相同 |
分析 A.石油裂解可获得乙烯,煤焦油中含有苯;
B.棉、麻成分都属于纤维素;
C.纯碱和二氧化硅反应生成硅酸钠和二氧化碳,焦炭冶炼铁一氧化碳和氧化铁反应生成铁和二氧化碳;
D.“地沟油”的主要成分是甘油三酯,矿物油主要是烃.
解答 解:A.石油的裂解是一种使烃类分子分裂为几个较小分子的反应过程,可获得乙烯,煤焦油中含有苯,故A正确;
B.棉、麻成分都属于纤维素,故B正确;
C.纯碱和二氧化硅反应生成硅酸钠和二氧化碳,焦炭冶炼铁一氧化碳和氧化铁反应生成铁和二氧化碳,都会产生温室气体,故C正确;
D.地沟油是加工过的餐饮废弃油,主要成分是甘油三酯,矿物油是通过蒸馏方法从石油中提炼出的基础油矿物油,主要是碳氢化合物,故D错误.
故选D.
点评 本题考查有机物的组成和性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,①的最高价氧化物的电子式为
,①的最高价氧化物的电子式为 .
.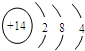 ,其最高价氧化物形成的晶体类型为原子晶体.
,其最高价氧化物形成的晶体类型为原子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可获得石油气、汽油、苯及其同系物等 | |
| B. | 石油催化裂化主要得到乙烯、乙炔等 | |
| C. | 煤含有苯和甲苯,可干馏后获得苯和甲苯 | |
| D. | 煤的液化、气化属于均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )
S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )| A. | S-诱抗素核磁共振氢谱图中有11组峰 | |
| B. | 咖啡酸乙脂能使酸性KMnO4溶液褪色 | |
| C. | 两者都不能与金属钠反应放出氢气 | |
| D. | 两者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 推论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性一般比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与钠反应生成H2 | 可通过加钠观察是否有气泡产生的方法鉴别乙醇的水溶液和乙醛的水溶液 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 除氢元素外,非金属元素都在p区,d区元素全部是金属.
除氢元素外,非金属元素都在p区,d区元素全部是金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为NH3,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是NaOH | ||
| C. | 若甲为NaOH溶液,则丁可能是CO2 | D. | 若甲为SiO2,则丁可能是C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )| A. | 放电时,电解质溶液中H2SO4的浓度将变大 | |
| B. | 放电时,正极反应式为:Pb+SO42--2e-=PbSO4 | |
| C. | 放电后用如图所示装置充电,电解质溶液中H+移向左边(PbO2极) | |
| D. | 用如图所示装置充电,阳极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
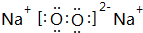 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com