
| A. | 锂 | B. | 铍 | C. | 氧 | D. | 钙 |
科目:高中化学 来源: 题型:解答题
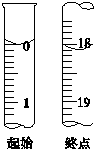 测定产品纯度
测定产品纯度查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH小于7 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | D. | c(CH3COOH)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Fe,负极为Zn,电解质Fe2(SO4)3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质FeCl3溶液 | |
| C. | 正极为Cu,负极为Fe,电解质Fe(NO3)3溶液 | |
| D. | 正极为Ag,负极为Fe,电解质Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
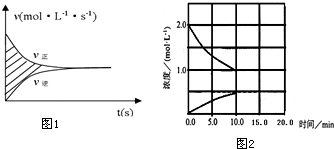
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、②、⑥分子中碳原子数小于10,③、⑤分子中碳原子数大于10 | |
| B. | ①、②是无机物,③、⑤、⑦是有机物 | |
| C. | ①、④是酸,③、⑤不是酸 | |
| D. | ②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 甲烷和乙烯都能与Cl2发生反应 | |
| C. | 乙烯可以合成有机高分子材料 | |
| D. | 苯和乙醇都能被酸性KMnO4溶液氧化而使KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com