
【题目】银锌电池广泛用作各种电子仪器的电源,其电极分别为![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,总反应式为
溶液,总反应式为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.原电池放电时,负极上发生反应的物质是![]()
B.负极的电极反应是![]()
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的![]() 向正极移动
向正极移动
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、![]() 和
和![]() )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。

A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(![]() )>c(H2SO3)> c(
)>c(H2SO3)> c(![]() )
)
C.由 M 点坐标,可以计算H2SO3H++![]() 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____。

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____,_____(任意写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,25 ℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随![]() 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

A.向Na2A溶液加入H2A过程中,水电离的c(OH-)不断增大
B.NaHA溶液中:c(H+)>c(OH-)
C.H2A的第二步电离常数的数量级为10-8
D.当吸收液呈中性时:c(Na+)=2c(A2-)+c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中 CO2 的含量及有效地开发利用 CO2,已受到各国的普遍重视。目前工业上有一种方法是用 CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为 1L 的恒容密闭容器中,充入 1mol CO2 和 3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2 和 CH3OH(g)的浓度随时间变化如下图所示。
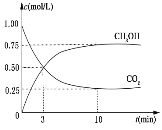
(1)在恒温恒容条件下,下列能说明反应达到化学平衡状态的是 _________(选填字母)
A.体系压强不再改变 B.气体密度不再改变 C.CO2 的浓度不再改变 D.v 正(CO2)= v 逆(H2)
(2) 从反应开始到平衡,氢气的平均反应速率 v(H2)=________mol/(L·min)。
(3)在该温度下,该反应的平衡常数为_________(保留小数点后 2 位)。
(4)下列措施中能使平衡体系中 n(CH3OH)/n(CO2)增大的是_________(选填字母)。
A.升高温度 B.充入 He(g),使体系压强增大 C.将 H2O(g)从体系中分离出去 D.再充入 1mol H2
(5)当反应达到平衡时,H2 的物质的量浓度为 c1,然后向容器中再加入一定量 H2,待反应再一次达到平衡后,H2 的物质的量浓度为 c2,则 c1________________c2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所设计了一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
则8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ΔH=___kJ·mol-1。
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,氨硼烷还可作燃料电池,其工作原理如图1所示。氨硼烷电池工作时正极的电极反应式为__________。

(3)常见含硼的化合物有NaBH4、NaBO2,已知NaBH4溶于水生成NaBO2、H2,写出其化学方程式_______。![]() 为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
(4)燃油汽车尾气含有大量的NO,在活化后的V2O5催化作用下,氨气将NO还原成N2的一种反应历程如图3所示。

根据图写出总反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应IO3-+5I-+6H+![]() 3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流表指针发生偏转,一段时间后,电流表指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流表指针再次发生偏转。下列判断不正确的是
3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流表指针发生偏转,一段时间后,电流表指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流表指针再次发生偏转。下列判断不正确的是

A. 开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B. 开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C. 电流表读数为零时,反应达到化学平衡状态
D. 两次电流表指针偏转方向相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种有机物之间的转化关系:

(1)反应①,用 O2 氧化,反应条件为_________________。
(2)反应③的化学方程式是___________________。
(3)用 18O 标记乙醇分子中的氧原子,反应⑤生成物中含 18O 的物质结构简式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮肥厂用NH3经一系列反应制得HNO3。NH3→NO→NO2→HNO3。
(1)25℃时,NH3和O2能反应生成NO和液态水,生成6mol水时放热1289kJ,其热化学方程式是_____。
(2)对于反应2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
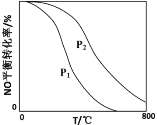
请比较P1、P2的大小:P1____P2(填“>”、“=”或“<”);该反应△H____0(填“>”、“=”或“<”)。
(3)四氧化二氮和二氧化氮可互相转化。在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
①该反应的△H_____0(填“>”、“=”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____molL-1s-1,该温度下反应的平衡常数K=_____。
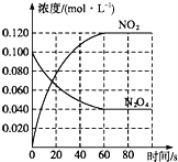
②反应达平衡后,将反应容器的容积缩小到原来的一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)25℃时,将0.1mol·L-1盐酸滴入20mL0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
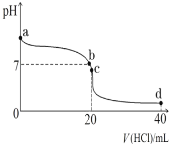
①写出NH3·H2O的电离方程式:_____。
②b点所示溶液中c(Cl-)_____c(NH![]() )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
③c点所示溶液中,离子浓度由大到小的顺序是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com