
【题目】下列各组物质相互混合后,不会发生离子反应的是( )
A.Na2SO4溶液和MgCl2 溶液 B.Na2CO3溶液和稀硫酸
C.NaOH溶液和Fe2(SO4)3溶液 D.Ca(OH)2和盐酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 丙烷没有同分异构体
B. CH(CH3)2CH2CH2CH3 的一氯代物有4种
C. 二氯苯有3种,则四氯苯有6种
D. CH3OH与CH2OH-CH2OH都属于醇,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
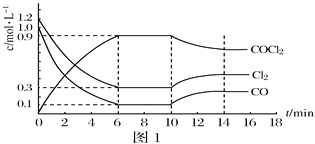
①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
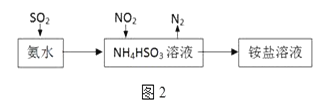
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。
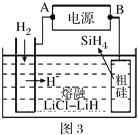
(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业中氢气可由天然气和水反应制备,其 主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:
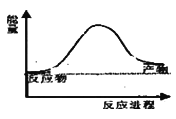
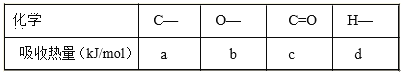
则消耗 1molCH4 吸收或放出热量为___________________kJ(用含 a b c d 字母的代数式表示)。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+CO![]() CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用 CO2 表示的平均反应速为_____________。
②假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为_________________。
③平衡时,NO2 的转化率为_________________。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____________。
A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2
B.NO2 的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.v 正(NO)=v 逆(CO)
E.容器内压强不再发生变化
F.容器内气体的密度保持不变
G.温度和压强一定时,混合气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO32-+6H2O.则下列说法正确的是
A. 电池放电时通入空气的电极为负极
B. 由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大
C. 电池放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O
D. 电池放电时每消耗1 mol CH3OH转移8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质,请用序号填空。
①金刚石与“足球烯” C 60 ;② D 与 T ;③氧气与臭氧;④CH4 和 CH3CH2 CH3 ;⑤ 和CH3CH2CH2CH2CH3;⑥
和CH3CH2CH2CH2CH3;⑥ 和和 CH3CH2CH2CH3
和和 CH3CH2CH2CH3
属于同位素的是________________,属于同系物的是_______________,属于同素异形体的是____________,属于同 分异构体的是______________。
(2)已知一定条件下,金刚石转化为石墨释放出能量,则等质量的金刚石比石墨具有的能量__________(填“高”、“低”),故金刚石比石墨稳定性______(填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二 氧化碳,____________放出热量多。
(3)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
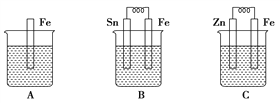
①B 中 Sn 极的电极反应式为____________________,
Sn 极附近溶液的 pH___________________。
②C 中总反应离子方程式为_________________。 比较 A、B、C 中铁被腐蚀的速率,由快到慢的顺 序是___________。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
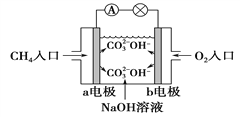
①电池的负极是____________(填“a”或“b”)电极, 该极的电极反应是_______________________。
② 电池工作一段时间后电解质溶液的 pH______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1 L的密闭容器中,充入1 mol H2(g)和1 mol I2(g),发生反应H2(g) + I2(g) ![]() 2 HI(g),经充分反应达到平衡后,HI(g)的气体体积分数为50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g) 发生反应HI(g)
2 HI(g),经充分反应达到平衡后,HI(g)的气体体积分数为50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g) 发生反应HI(g) ![]()
![]() H2(g) +
H2(g) +![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A. 第二个反应的平衡常数为1
B. 第二个反应的平衡常数为0.05
C. 第二个反应达到平衡时,H2的平衡浓度为0.25 mol/L
D. 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
①30g由乙酸和葡萄糖组成的混合物中含有氢原子的数目为2NA
②Na2O2固体与水反应生成0.5molO2时转移电子数为NA
③1L0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和小于0.1NA
④标准状况下,2.24L的一氯甲烷中含有的碳氢共价键的数目为0.3NA
A. 4个 B. 3个 C. 2个 D. 1个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com